
【题目】化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等。
(1)下列ΔH表示物质燃烧热的是_____(填ΔH1、ΔH2或ΔH3,下同);表示中和热的是____。
A. 2H2(g)+O2(g)=2H2O(l) ΔH1
B. C(s)+ O2(g)=CO(g) ΔH2
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3
D. C(s)+ O2(g)=CO2(g) ΔH4
E. C6H12O6(s)+6O2(g)=6CO2(g) +6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq)=NaSO4(aq)+2H2O(l) ΔH7
(2)已知15g乙烷完全燃烧生成CO2和液态水,放热akJ,下列热化学方程式正确是(________)。
A. C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ΔH1=+2a kJ·mol-1
B. C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ΔH1=-2a kJ·mol-1
C. 2C2H6(g)+ 7O2(g)=4CO2(g)+6H2O(l) ΔH1=-4a kJ·mol-1
D. 2C2H6(g)+ 7O2(g)=4CO2(g)+6H2O(l) ΔH1=+4a kJ·mol-1
(3)充分燃烧一定量丁烷(C4H10)放出热量161.9kJ,且生成的CO2恰好能与2.5mol/L 100mL的氢氧化钡溶液完全反应生成沉淀,则燃烧1mol丁烷放出能量为__________。
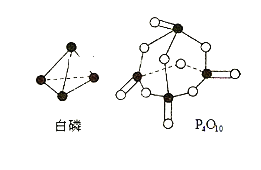
(4)进一步研究表明,化学反应能量变化与键能有关,键能简单理解断开1mol化学键吸收能量。下表是键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | 197 | 360 | 499 | X |
已知白磷燃烧热为2378.0kJ·mol-1,则X=__________。
【答案】ΔH3 ΔH4 ΔH5 ΔH6 BC 2590.4kJ 433.75
【解析】
(1)燃烧热指1mol物质完全燃烧生成稳定的氧化物的反应热,一般H→H2O(l)、C→CO2(g)、S→SO2(g),中和热指稀溶液中酸与碱反应生成1molH2O的反应热热量,据此分析判断;
(2)15g乙烷的物质的量为![]() =0.5mol,完全燃烧生成CO2和液态水,放热akJ,结合燃烧热的概念分析判断;
=0.5mol,完全燃烧生成CO2和液态水,放热akJ,结合燃烧热的概念分析判断;
(3)CO2恰好与氢氧化钡溶液完全反应生成碳酸钡,根据n=cV计算氢氧化钡的物质的量,从而计算n(BaCO3),根据碳元素守恒由n(CO2)= n(BaCO3),进而计算丁烷的物质的量,据此分析计算;
(4)根据反应热等于反应物的总键能与生成物的总键能之差,结合反应热计算键能。
(1)A.氢气的物质的量为2mol,反应热△H1不能表示燃烧热;
B.碳燃烧的生成物为CO,稳定的氧化物是CO2,反应热△H2不能表示燃烧热;
C.1mol甲烷完全燃烧,生成二氧化碳气体和液态的水,是稳定的状态,故反应热△H3能表示燃烧热;
D.C(s)+O2(g)═CO2(g)△H4中1molC完全燃烧生成二氧化碳,符合燃烧热概念,反应热△H4能表示燃烧热;
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5中1molC6H12O6完全燃烧生成二氧化碳与液态水,符合燃烧热概念,反应热△H5能表示燃烧热;
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6中实质是1mol氢离子与1mol氢氧根离子反应生成1molH2O,符合中和热概念,反应热△H6能表示中和热;
G.2NaOH(ag)+H2SO4(ag)═Na2SO4(ag)+2H2O(l) △H7,反应生成的水为2mol,△H7不能表示中和热;
表示物质燃烧热的是△H3、△H4、△H5,表示中和热的是△H6,故答案为:△H3、△H4、△H5;△H6;
(2)15g乙烷的物质的量为![]() =0.5mol,完全燃烧生成CO2和液态水,放热akJ。
=0.5mol,完全燃烧生成CO2和液态水,放热akJ。
A.C2H6(g)+![]() O2(g)═2CO2(g)+3H2O(l) △H1=+2akJ/mol在热化学反应方程式中△H>0,表示吸热,而C2H6燃烧反应是放热反应,故A错误;
O2(g)═2CO2(g)+3H2O(l) △H1=+2akJ/mol在热化学反应方程式中△H>0,表示吸热,而C2H6燃烧反应是放热反应,故A错误;
B.C2H6(g)+![]() O2(g)═2CO2(g)+3H2O(l) △H2=-2akJ/mol,完全燃烧1mol乙烷生成二氧化碳和液态水放热2akJ,故B正确;
O2(g)═2CO2(g)+3H2O(l) △H2=-2akJ/mol,完全燃烧1mol乙烷生成二氧化碳和液态水放热2akJ,故B正确;
C.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l) △H3=-4akJ/mol,完全燃烧2mol乙烷生成二氧化碳和液态水放热4akJ,故C正确;
D.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l) △H4=+4akJ/mol,在热化学反应方程式中△H>0,表示吸热,而C2H6燃烧反应是放热反应,故D错误;
正确的有BC,故答案为:BC;
(3)氢氧化钡的物质的量为0.1L×2.5mol/L=0.25mol,n(BaCO3)=0.25mol,根据碳元素守恒由n(CO2)= n(BaCO3)=0.25mol,根据碳元素守恒可知,丁烷的物质的量n(C4H10)=![]() ×0.25mol=
×0.25mol=![]() mol,放出热量161.9kJ,所以1mol丁烷完全燃烧放出的热量为161.9kJ×
mol,放出热量161.9kJ,所以1mol丁烷完全燃烧放出的热量为161.9kJ× =2590.4kJ,故答案为:2590.4kJ;
=2590.4kJ,故答案为:2590.4kJ;
(4)白磷燃烧的热化学方程式为P4(s)+5O2(g)═P4O10(s)△H=-2378.0kJ/mol,则6×197kJ/mol+5×499kJ/mol-12×360kJ/mol-4X=-2378kJ/mol,解得:X=433.75kJ/mol,故答案为:433.75。


科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)具有强氧化性,是一种新型多功能水处理剂,其生产工艺流程如下:
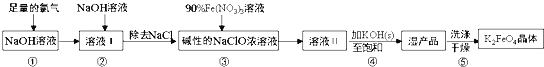
已知:K2FeO4在水溶液中易发生反应:4FeO42+10H2O4Fe(OH)3+8OH-+3O2↑,下列说法不正确的是( )
A.步骤③中氧化剂与还原剂的物质的量之比为3:2
B.步骤④中Na2FeO4转变为湿产品是因为K2FeO4溶解度更小
C.步骤⑤中的洗涤剂可用CH3COOK和异丙醇来配制
D.配制90%Fe(NO3)3溶液必需的玻璃仪器有容量瓶、烧杯、量筒、玻璃棒、胶头滴管等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室常用的部分仪器,请回答下列问题

(1)序号为⑧和⑩的仪器名称分别为__________、__________。
(2)在分液操作中,必须用到上述仪器中的________(填序号)。
(3)能作反应仪器且可直接加热的仪器上述中的___________(填名称)。
(4)在配制一定物质的量浓度的溶液时,需要用到的仪器是___________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A. 甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJmol-1
B. 已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H < -57.3kJmol-1
BaSO4(s)+H2O(l) △H < -57.3kJmol-1
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D. 已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O3比O2稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol白磷(P4,s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是

A.红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g)=P4O10(s) ΔH=-(E2-E3)kJ mol-1
B.P4(s,白磷) = 4P(s,红磷) ΔH>0
C.白磷比红磷稳定
D.以上变化中,白磷和红磷所需活化能相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,充入1molN2和3molH2,并在一定温度和压强下,使其发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH= -92.4 kJ·mol-1。回答下列问题:
2NH3(g) ΔH= -92.4 kJ·mol-1。回答下列问题:
(1)若保持容器容积不变,再向其中充入1molN2,反应速率会________(填“加快”“减慢”或“不变”,下同),理由是____________。
(2)若保持容器容积不变,再向其中充入1molHe,反应速率会________,理由是________。
(3)若保持容器内气体压强不变,再向其中充入1molHe,反应速率会________,理由是___________。
(4)加入催化剂,反应速率会________,理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe3O4的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A. 11.2gB. 5.6gC. 2.8gD. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸性溶液X中可能含有Na+ , K+、NH4+、 Fe3+、Fe2+、Al3+、CO32-、 SO32-、SO42-、C1-的若干种,某同学为了确认其成分,取X溶液进行连 续实验,实验过程及产物如下所示:
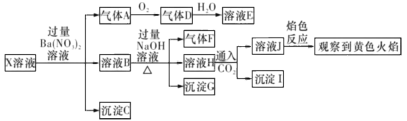
下列结论止确的是
A.气体A是SO2,证明原溶液中含有SO32-
B.沉淀G中加人盐酸溶解,滴加KSCN溶液显红色,可以确定原溶液中 有Fe3+
C.沉淀I―定是A1(OH)3
D.X中不能确定的离子是Al3+、Fe3+ 、Na+ 、K +和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算填空:
(1)2 mol尿素[CO(NH2)2]含_____________个H原子,所含氧原子跟__________g H2O所含氧原子个数相等。
(2)①标准状况下,22.4 L CH4;②1.5 mol NH3;③1.806×1024个H2O;④标准状况下,73 g HCl。所含H原子个数由多到少的顺序是____________________。
(3)30.9 g NaR含有Na+0.3 mol,则NaR的摩尔质量为_________________。
(4)100mL某Al2(SO4)3溶液中,c(Al3+)=2.0 mol·L-1,则其中c(SO42-)=_________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com