
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A. 甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJmol-1
B. 已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H < -57.3kJmol-1
BaSO4(s)+H2O(l) △H < -57.3kJmol-1
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D. 已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O3比O2稳定
【答案】B
【解析】
A. 甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJmol-1,故A错误;
B. 已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,由于钡离子与硫酸根离子生成硫酸钡的反应为放热反应,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H < -57.3kJmol-1,故B正确;
BaSO4(s)+H2O(l) △H < -57.3kJmol-1,故B正确;
C. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,由于该反应为可逆反应,则平衡时消耗氮气的物质的量小于0.5mol,即1mol氮气与氢气完全反应放出热量大于38.6kJ,则正确的热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H <-38.6kJmol-1,故C错误;
2NH3(g) △H <-38.6kJmol-1,故C错误;
D. ①4Al(s)+3O2(g)=2A12O3,△H=-2834.9kJmol-1②4Al(s)+2O3(g)=2A12O3,△H=-3119.1gkJmol-1,根据盖斯定律①-②可得:302(g)=203(g)△H=-2834.9kJmol-1-(-3119.1kJmol-1)=+284.2kJmol-1,该反应为吸热反应,说明氧气的能量小于臭氧,则氧气比臭氧稳定,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】研究化学反应能量变化、化学反应速率和化学反应限度,在实际工业生产和生活中有着重要的意义。回答下列问题:
(1)科学家提出可利用FeO吸收和利用CO2,其原理为:
已知:C(s)+2H2O(g)====CO2(g)+2H2(g) △H=+113.4kJ·mol-1
3FeO(s)+H2O(g)====Fe3 O4(s)+H2(g) △H=+18.7kJ·mol-1
则反应6FeO(s)+CO2(g)====2Fe3O4(s)+C(s)的△H=_______。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2O![]() HClO+OH-。常温下,该水解反应的平衡常数为Kh=1.0×10-6mol·L-1,则1.0mol·L-1NaClO溶液的pH=______。
HClO+OH-。常温下,该水解反应的平衡常数为Kh=1.0×10-6mol·L-1,则1.0mol·L-1NaClO溶液的pH=______。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g) △H>0
HCN(g)+3H2 (g) △H>0
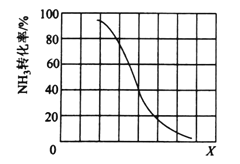
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如下图所示。X代表的是______(填“温度”或“压强”)。
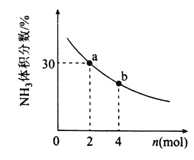
②其他条件一定,向2L密闭容器中加入nmolCH4和2molNH3,平衡时NH3体积分数随n变化的关系如下图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为______;该温度下,b点的平衡常数为________
(4)纳米氧化亚铜Cu2O是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备。电解过程中无气体产生,则铜棒作______极,阴极生成Cu2O的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.35g二氧化锰与浓盐酸(密度为1.19gcm﹣3、质量分数为36.5%)完全反应.求:
(1)浓盐酸的物质的量浓度为多少?_______
(2)将所得气体全部用石灰乳吸收,可得到漂白粉的质量.________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g)△H>0,0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是
H2(g)+I2(g)△H>0,0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是
A. 当HI、H2、I2浓度之比为2:1:1时,说明该反应达平衡
B. c(HI)由0.07mol/L降到0.05mol/L所需的反应时间小于10s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 0~15s内用I2表示的平均反应速率为:v(I2)=0.001mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期律与周期表是学习元素化合物知识的重要工具。C与Si,N与P分别位于同一主族。其气态氢化物的分解温度如下表:
物质 | CH4 | SiH4 | NH3 | PH3 |
分解温度/K | 873 | 773 | 1073 | T |
(1)CH4分解温度高于SiH4的原因是_________。
(2)仅依据元素非金属性强弱关系,预测PH3分解温度(T)的范围________;
(3)某同学为证明非金属性![]() ,设计如图装置:
,设计如图装置:
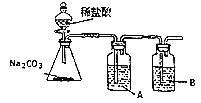
①A处盛放的试剂是__________;
②B中出现的现象是______;B处发生的离子反应方程式为_____________;
③该同学的设计中存在的问题是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述错误的是
A. 在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若电子转移的数目为5NA,则有212克氯气生成
B. 常温常压下,40g氖气所含的分子数目为2NA
C. 含2molH2SO4的浓硫酸与足量Zn完全反应,转移的电子数目可能为3NA
D. 标准状况下,33.6L Cl2与足量CH4在光照条件下充分反应,生成的C-Cl键数目为3.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有48.4g碱式碳酸镁样品(化学式:xMgCO3·yMg(OH)2·zH2O,x、y、z为正整数),将其分为二等份,一份样品充分灼烧至恒重进行热重分析,结果如图所示。另一份投入150mL某溶液的盐酸中,充分反应后生成CO24.48L(已知算成标准状况下),所得溶液稀释至250mL,测得溶液的c(H+)=0.100mol/L。

按要求回答下列问题:
(1)盐酸的物质的量浓度c(HCl)=______mol/L
(2)x:y:z=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,W、Z核外电子数之和是X核外电子数的2倍,Y的最外层电子数是其质子数的![]() 。下列叙述正确的是
。下列叙述正确的是
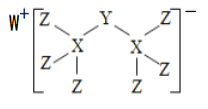
A. Y元素对应的最高价氧化物的水化物是强酸
B. 原子半径:X>Y>Z
C. 该新化合物中的Y元素不满足8电子稳定结构
D. Y、Z两元素可形成离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com