
【题目】研究化学反应能量变化、化学反应速率和化学反应限度,在实际工业生产和生活中有着重要的意义。回答下列问题:
(1)科学家提出可利用FeO吸收和利用CO2,其原理为:
已知:C(s)+2H2O(g)====CO2(g)+2H2(g) △H=+113.4kJ·mol-1
3FeO(s)+H2O(g)====Fe3 O4(s)+H2(g) △H=+18.7kJ·mol-1
则反应6FeO(s)+CO2(g)====2Fe3O4(s)+C(s)的△H=_______。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2O![]() HClO+OH-。常温下,该水解反应的平衡常数为Kh=1.0×10-6mol·L-1,则1.0mol·L-1NaClO溶液的pH=______。
HClO+OH-。常温下,该水解反应的平衡常数为Kh=1.0×10-6mol·L-1,则1.0mol·L-1NaClO溶液的pH=______。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g) △H>0
HCN(g)+3H2 (g) △H>0
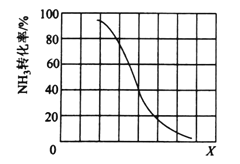
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如下图所示。X代表的是______(填“温度”或“压强”)。
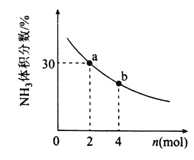
②其他条件一定,向2L密闭容器中加入nmolCH4和2molNH3,平衡时NH3体积分数随n变化的关系如下图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为______;该温度下,b点的平衡常数为________
(4)纳米氧化亚铜Cu2O是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备。电解过程中无气体产生,则铜棒作______极,阴极生成Cu2O的电极反应式为________。
【答案】-76.0kJ·mol-1 11 压强 0.025mol·L-1·min-1 3/16 阳 2Cu2++2e-+H2O=Cu2O+2H+
【解析】
(1)已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1①,3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) △H=+18.7kJ·mol-1②,根据盖斯定律,②×2-①可得6FeO(s)+CO2(g)==2Fe3O4(s)+C(s),△H=(+18.7kJ·mol-1)×2-(+113.4kJ·mol-1)= -76.0kJ·mol-1,故答案为:-76.0kJ·mol-1。
(2)1.0mol·L-1NaClO溶液中,c(ClO-)=1.0mol·L-1,已知ClO-+H2O![]() HClO+OH-,该水解反应的平衡常数K=c(HClO)c(OH-)/c(ClO-)=c2(OH-)=1.0×10-6mol·L-1,c(OH-)=1.0×10-3mol·L-1,则c(H+)=Kw/c(OH-)=10-14/10-3=10-11,则pH=11,故答案为:11。
HClO+OH-,该水解反应的平衡常数K=c(HClO)c(OH-)/c(ClO-)=c2(OH-)=1.0×10-6mol·L-1,c(OH-)=1.0×10-3mol·L-1,则c(H+)=Kw/c(OH-)=10-14/10-3=10-11,则pH=11,故答案为:11。
(3)①根据图示,X越大转化率越小,平衡逆向移动,该反应为吸热反应,温度升高平衡正向移动,增大压强,平衡逆向移动,故答案为:压强。
②设10min时,反应的氨气的物质的量为x,
CH4(g)+NH3(g)![]() HCN(g)+3H2(g)
HCN(g)+3H2(g)
开始(mol) 2 2 0 0
反应(mol) x x x 3x
a点(mol) 2-x 2-x x 3x
则(2-x)/(2-x+x+3x)×100%=30%,解得x=0.5mol,
v(CH4)=△c/△t=0.5mol/2L/10min=0.025mol·L-1·min-1,
此时c(HCN)=0.5mol/2L=0.25mol/L,c(H2)=0.5mol×3/2L=0.75mol/L,c(CH4)=c(NH3)=(2-0.5)mol/2L=0.75mol/L,
平衡常数只与温度有关,所以Ka=Kb=c(HCN)c3(H2)/c(CH4)c(NH3)=0.25×(0.75)3/0.75×0.75=3/16,故答案为:0.025mol·L-1·min-1,3/16。
(4)要生成氧化亚铜,则铜必须失去电子,因此铜作阳极。阴极得到电子,发生还原反应,所以阴极电极反应式为2Cu2++2e-+H2O=Cu2O+2H+,
故答案为:阳,2Cu2++2e-+H2O=Cu2O+2H+。


科目:高中化学 来源: 题型:
【题目】下列反应既属于离子反应又属于氧化还原反应的是 ( )
A.C+O2 ![]() CO2
CO2
B.2 KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
C.HCl+NaOH = NaCl+H2O
D.Fe+CuSO4=Cu+FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。在周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧,除生成Li2O外,也生成微量的_________(填化学式)。
(2)铍的最高价氧化物对应的水化物属两性化合物,证明这一结论的有关离子方程式为_______________________________________________________________。
(3)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),a属于________(填“离子”或“共价”)化合物,写出它的一个等电子体_________。
(4)二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为__________(标出配位键)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A. HOCH2CH(CH3)2与(CH3)3COH属于碳链异构
B. ![]() 的核磁共振氢谱表明其有3种不同化学环境的氢
的核磁共振氢谱表明其有3种不同化学环境的氢
C. 除去乙酸乙酯中的乙酸和乙醇杂质,可加入足量烧碱溶液,通过分液即得乙酸乙酯
D. 用酸性高锰酸钾溶液鉴别苯甲醇、乙醇和苯甲醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组实验室制取乙酸乙酯时查阅资料如下:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,根据查得的资料设计了下图所示的装置(夹持装置忽略)制取纯净的乙酸乙酯。步骤如下:
CH3COOC2H5+H2O,根据查得的资料设计了下图所示的装置(夹持装置忽略)制取纯净的乙酸乙酯。步骤如下:
①在下图的三口烧瓶中加入3mL乙醇,边摇动边慢慢加入3mL浓硫酸,在分液漏斗中装入3:2的乙醇和乙酸混合液。
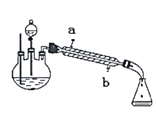
②油浴加热三口烧瓶至一定温度,然后把分液漏斗中的混合液慢慢地滴入三口烧瓶里并保持反应混合物在一定温度。
③反应一段时间后,向锥形瓶中缓慢加入饱和Na2CO3溶液,并不断摇动,分层后进行分液。
④用饱和食盐水和氯化钙溶液洗涤酯层,再分液,在酯层加入干燥剂干燥得粗乙酸乙酯。
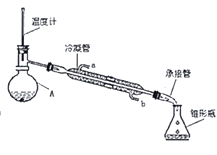
⑤将粗乙酸乙酯转入下图的仪器A中,在水浴中加热,收集74~80℃的馏分即得纯净的水果香味无色透明液体。
根据题目要求回答:
(1)在实验中浓硫酸的作用_____________;
(2)歩骤②中油浴加热保持120-125℃温度范围,如果温度在170℃,则发生一个副反应,请写出该反应的化学方程式_______
(3)图2中仪器A的名称是____________,冷凝管中冷水从______(填a或b)口进入。
(4)步骤③和④中都用到了分液操作,该操作用到的主要玻璃仪器是_________,在分液操作时,上下两层液体移出的方法是_______。
(5)步骤④中干燥乙酸乙酯,可选用的干燥剂为______(填字母)。
a.五氧化二磷 b.无水Na2SO4 c.碱石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组设计了如图所示的数字化实验装置,研究常温下,向30 mL 0.1 mol·L1 H2A溶液中逐滴加入等浓度NaOH溶液时pH变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系(如图所示),下列说法错误的是
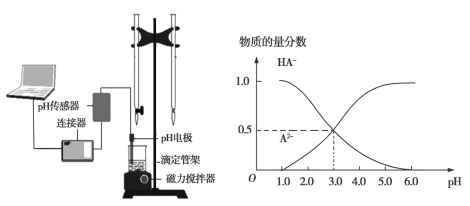
A. pH=4.0时,溶液中n(HA)约为2.73×104 mol
B. 该实验应将左边的酸式滴定管换成右边碱式滴定管
C. 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
D. 0.1 mol·L1NaHA溶液中存在c(A2)+c(HA)+c(H2A)=0.1 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】螺环化合物具有抗菌活性,用其制成的药物不易产生抗药性,螺[3,4]辛烷的结构如图,下列有关螺[3,4]辛烷的说法正确的是( )

A. 分子式为C8H16B. 分子中所有碳原子共平面
C. 与2—甲基—3—庚烯互为同分异构体D. 一氯代物有4种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求作答:
(1)分子式为C4H8且属于烯烃的有机物的同分异构体(考虑顺反异构)有 _________种;![]() 高聚物的单体的结构简式是_____________ 和______________。
高聚物的单体的结构简式是_____________ 和______________。
(2) ![]() 的名称为:_______________;写出
的名称为:_______________;写出![]() 聚合生成高分子化合物的化学方程式________;
聚合生成高分子化合物的化学方程式________;
(3)已知-NH2表现碱性,-NO2表现中性,-COOH表现酸性。化学式为C7H7NO2的有机物,其分子结构中有1个苯环、2个取代基,试按照下列写出2种同分异构体(只写邻位即可)。
①该有机物既有酸性又有碱性______________。
②该有机物既无酸性又无碱性______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A. 甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJmol-1
B. 已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H < -57.3kJmol-1
BaSO4(s)+H2O(l) △H < -57.3kJmol-1
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D. 已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O3比O2稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com