
【题目】下列反应既属于离子反应又属于氧化还原反应的是 ( )
A.C+O2 ![]() CO2
CO2
B.2 KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
C.HCl+NaOH = NaCl+H2O
D.Fe+CuSO4=Cu+FeSO4
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】实验室用NaOH固体配制240mL 1.00mol/L的NaOH溶液,回答下列问题:
(1)配制1.00mol/L的NaOH溶液,应称取NaOH的质量_______g,需要的仪器为:量筒、烧杯,玻璃棒、托盘天平、砝码、______ 、______。
(2)容量瓶上需标有以下五项中的_____________________;
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
F.用胶头滴管加水至溶液凹液面与刻度线相切
(4)下列配制的溶液浓度偏低的是____________
A.称量NaOH时,将NaOH放在纸上称重
B.配制前,容量瓶中有少量蒸馏水
C.配制时,NaOH未冷却直接定容
D.加蒸馏水时不慎超过了刻度线
E.定容时俯视刻度线
F.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将30mL0.5mol/L的H2SO4溶液加水稀释到500mL后,从中取出50mL溶液的物质的量浓度为___。
(2)常温下,将20.0g14%的NaOH溶液跟30.0g24%的NaOH溶液混合,混合后得到1.2g/mL的混合液,试计算:
①混合后的溶液中NaOH的质量分数为___。
②混合后的溶液中NaOH的物质的量浓度为___mol/L。
③配制100mL同浓度溶液需要溶解___g的NaOH才能使其浓度与上述混合液浓度相等。
(3)在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,该混合气体中,CO和CO2的物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)物质的量相等的 CO 和 CO2 中,同温同压下所占的体积比为____,原子个数之比为______;
(2)1.8g水与_______mol硫酸所含的分子数相等,它们所含氧原子数之比是________,其中氢原子数之比是___________。
(3)3.2g某气体中含有的分子数约为3.01×1022,此气体的摩尔质量为________。
(4)可用于分离或提纯物质的方法有:
A 过滤 B 萃取 C 渗析 D 蒸馏 E 灼热氧化 F 分液.
如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
①除去淀粉溶液中的少量碘化钠________; ②提取溴水中的溴单质______;
③除去水中的Na+、![]() 、Cl-等杂质________; ④除去CuO中的Cu ______;
、Cl-等杂质________; ④除去CuO中的Cu ______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。某草酸亚铁样品(不含结晶水)中含有少量草酸,现用滴定法测定该样品中FeC2O4的含量。实验方案如下:
①将0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol·L-1的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol·L-1的H2SO4溶液,煮沸5~8 min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.020 00 mol·L-1的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 mL。
试回答下列问题:
(1)高锰酸钾标准液用________滴定管盛装(填“酸式”或“碱式”)。
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为______________________________________________________。
(3)滴定过程中眼睛应注视__________________ ,滴定终点现象是 ___________________
(4)在步骤②中,下列操作会引起测定结果偏高的是_____________。
a 滴定管在盛装高锰酸钾前未润洗
b 滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
c 滴定前读数正确,滴定终点时俯视读数
d 滴定前尖嘴有气泡,滴定后气泡消失
(5)0.20 g样品中FeC2O4的质量分数为____。(保留3位有效数字,不考虑步骤②中的损耗)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )

A.M点对应的溶液中:K+、Fe2+、SO![]() 、NO
、NO![]()
B.N点对应的溶液中:K+、NH![]() 、Cl、CO
、Cl、CO![]()
C.S点对应的溶液中:Na+、SO![]() 、HCO
、HCO![]() 、NO
、NO![]()
D.R点对应的溶液中:Na+、SO![]() 、Cl、NO
、Cl、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、将 5 g 钠铝合金投入到 200 mL 的水中,固体完全溶解,产生 4.48 L 标准状况下的气体,溶液中只有一种溶质。经过分析得出钠铝合金中两种金属的物质的量之比为_______,所得溶液中溶质的物质的量浓度为__________(假设溶液体积变化忽略不计)。
Ⅱ、把由 NaOH、AlCl3、MgCl2 三种固体组成的混合物溶于足量水中,有 0.58 g 白色难溶物析出,向所 得溶液中逐滴加人 0.5 mol L-1 的盐酸,加入盐酸的体积和生成沉淀的质量如下图所示:

请计算:
(1)混合物中 MgCl2 的质量__________g;
(2)P 点表示盐酸加入的体积_________ml。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年12月8日,凌晨2时23分,我国在西昌卫星发射中心,嫦娥四号探测器搭载长征三号乙运载火箭成功发射,实现了世界首次月球背面软着陆和巡视探测,被认为是中国在工程技术和空间科学方面的双重跨越和创新。
I.肼(N2H4)又称联氨,常温时是一种可燃性的液体,可用作火箭燃料。
(1)已知在25℃、101kPa时,16g N2H4在氧气中完全燃烧生成氮气,放出312kJ的热量,则N2H4完全燃烧的热化学方程式是___________________________________________________。
II.如下图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
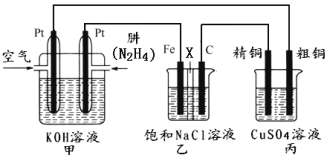
根据要求回答相关问题:
(2)甲装置中正极的电极反应式为:______________________________________。
(3)检验乙装置中石墨电极反应产物的方法是:___________________________。
(4)如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为___________g。
III.对金属制品进行抗腐蚀处理,可延长其使用寿命。该研究性学习小组又以肼(N2H4)─空气燃料电池为电源对铝材表面进行如下处理:
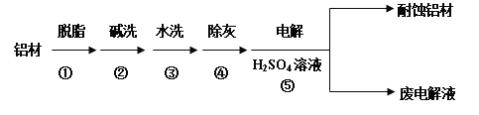
(5)流程⑤中以铝材为阳极,在H2SO4 溶液中电解,最终可在铝材表面形成氧化膜,该电解的阳极电极反应式为__________________________________。
(6)取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,其反应的离子方程式是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应能量变化、化学反应速率和化学反应限度,在实际工业生产和生活中有着重要的意义。回答下列问题:
(1)科学家提出可利用FeO吸收和利用CO2,其原理为:
已知:C(s)+2H2O(g)====CO2(g)+2H2(g) △H=+113.4kJ·mol-1
3FeO(s)+H2O(g)====Fe3 O4(s)+H2(g) △H=+18.7kJ·mol-1
则反应6FeO(s)+CO2(g)====2Fe3O4(s)+C(s)的△H=_______。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2O![]() HClO+OH-。常温下,该水解反应的平衡常数为Kh=1.0×10-6mol·L-1,则1.0mol·L-1NaClO溶液的pH=______。
HClO+OH-。常温下,该水解反应的平衡常数为Kh=1.0×10-6mol·L-1,则1.0mol·L-1NaClO溶液的pH=______。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g) △H>0
HCN(g)+3H2 (g) △H>0
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如下图所示。X代表的是______(填“温度”或“压强”)。
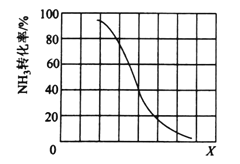
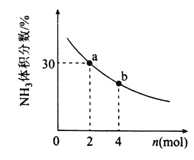
②其他条件一定,向2L密闭容器中加入nmolCH4和2molNH3,平衡时NH3体积分数随n变化的关系如下图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为______;该温度下,b点的平衡常数为________
(4)纳米氧化亚铜Cu2O是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备。电解过程中无气体产生,则铜棒作______极,阴极生成Cu2O的电极反应式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com