
����Ŀ��I���� 5 g �����Ͻ�Ͷ�뵽 200 mL ��ˮ�У�������ȫ�ܽ⣬���� 4.48 L ��״���µ����壬��Һ��ֻ��һ�����ʡ����������ó������Ͻ������ֽ��������ʵ���֮��Ϊ_______��������Һ�����ʵ����ʵ���Ũ��Ϊ__________(������Һ����仯���Բ���)��
���� NaOH��AlCl3��MgCl2 ���ֹ�����ɵĻ������������ˮ�У��� 0.58 g ��ɫ���������������� ����Һ����μ��� 0.5 mol L-1 �����ᣬ�����������������ɳ�������������ͼ��ʾ��

����㣺
��1��������� MgCl2 ������__________g��
��2��P ���ʾ�����������_________ml��
���𰸡�1:1 0.5mol/L 0.95g 130mL
��������
I����Һ��ֻ��һ�����ʣ�Ӧ����NaAlO2������ԭ���غ��֪�����Ͻ������ֽ��������ʵ�����ȣ��Դ˽��
��(1)��ͼ����֪����������þ������Ϊ0.58g������þԭ���غ����n(MgCl2)��������������
(2)B����Һ�д��ڵ��������Ȼ��ƣ�����ԭ���غ����֪��n(NaOH)=n(NaCl)����ԭ�������n(NaOH)=n(NaCl)=n(Cl-)=2 n(MgCl2)��P����ҺΪMgCl2��AlCl3��NaCl���Һ�����������غ����֪�����Ȼ�����������Դ�ڼ������ᣬ�����������غ����֪��n(NaOH)=n(NaCl)�����������������������
I����Һ��ֻ��һ�����ʣ�Ӧ����NaAlO2������ԭ���غ��֪�����Ͻ������ֽ��������ʵ���֮��Ϊ1:1�����ʵ�������![]() =0.1mol�����������Һ�����ʵ����ʵ���Ũ��Ϊ
=0.1mol�����������Һ�����ʵ����ʵ���Ũ��Ϊ![]() =0.5mol/L��
=0.5mol/L��
��ˣ�������ȷ���ǣ�1:1 ��0.5mol/L��
��(1)��ͼ����֪�����������ᣬ��ʼ�����������䣬�������г������ӣ�˵��NaOH����AlCl3ȫ����Ӧ����NaAlO2����ʣ�࣬����ж�0.58g����ΪMg(OH)2�����ʵ���Ϊ0.01mol�����������غ����֪��MgCl2Ҳ��0.01mol������Ϊ��95g/mol��0.01mol=0.95g��
��ˣ�������ȷ���ǣ�0.95g��
(2) ͼ��AB�η����ķ�Ӧ�ǣ�NaAlO2+HCl+H2O=Al(OH)3��+NaCl���ɷ���ʽ�ɵã�n(HCl)=n[Al(OH)3]=n(Al)=0.5mol/L��(0.03-0.01)L=0.01mol���������NaOH�����ʵ�����ʣ���NaOH��AlCl3��MgCl2���ĵ�NaOH���ʵ������ܺͣ���n(NaOH)=0.5mol/L��0.01L+0.01mol��4+0.01mol��2=0.065mol��P��ʱ���ĵ��������ԭNaOH�����ʵ���0.065mol����ʱ��������Ϊ��V=![]() =0.13L=130mL��
=0.13L=130mL��
��ˣ�������ȷ���ǣ�130mL��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Һ�У����ܴ������е��������±���
������ | H����K����Al3����NH |
������ | OH����SO42����CO32����AlO2�� |
��Na2O2�������������Һ�в��ȣ�����������������ͼ��ʾ��

����˵������ȷ���ǣ�
A. ���������Һ��һ����������H����NH4+��Al3����Mg2����SO42��
B. ͼ��a��4
C. b��7��c��9
D. ����Һ����Ҫ����ɫ��Ӧ�������飬����ȷ����Һȷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������п������������ϡ���ᷴӦ����������������m�뷴Ӧʱ��t�Ĺ�ϵͼ����������
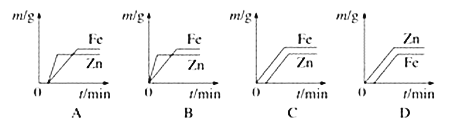
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������H��һ���л��������м��塣ʵ�����ɷ��㻯����A�Ʊ�H��һ�ֺϳ�·�����£�
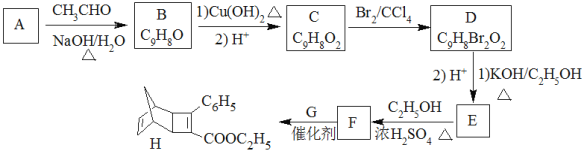
��֪��
![]()
![]()
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ_____________________��
��2����C����D��E����F�ķ�Ӧ���ͷֱ�Ϊ__________��_________��
��3��E�Ľṹ��ʽΪ________________________��
��4��GΪ�ױ���ͬ���칹�壬��F����H�Ļ�ѧ����ʽΪ________________________��
��5�����㻯����X��F��ͬ���칹�壬X���뱥��̼��������Һ��Ӧ�ų�CO2����˴Ź���������ʾ��4�ֲ�ͬ��ѧ�������⣬�������Ϊ6��2��1��1��д��1�ַ���Ҫ���X�Ľṹ��ʽ_____________________________��
��6��д���û������2-��ȲΪԭ���Ʊ�������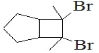 �ĺϳ�·��_______�������Լ���ѡ����
�ĺϳ�·��_______�������Լ���ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺
��1���� 28.5 g �Ȼ�þ����ˮ��ɵ� 500mL ��Һ�� Cl-Ũ����______________��д���Ȼ�þ�ĵ��뷽��ʽ_________________________________________________________��
��2���������� 50 g �� HCl��NH3��CO2��O2 �������壬����ͬ�¶Ⱥ���ͬѹǿ�����£����������____________��
��3������ 90 mL 0.1 mol/L CuSO4 ��Һ����Ҫ CuSO4��5H2O_______ g�����в�����ʹ������ҺŨ��ƫ�ߵ���__________________________��
A.����ƿϴ�Ӹɾ���δ���� B.���ݺ���ҡ�ȡ����ã�����Һ���½����ټ�����������ˮ
C.����ʱ���ӿ̶��� D.�ձ��Ͳ�����δϴ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������,�ı�0.lmol/L��H2R��Һ��pH,��Һ�С�R����ص����ķֲ�ϵ����(X)��pH�ı仯��ͼ��ʾ[��֪![]() ],�����й�˵������ȷ���ǣ� ��
],�����й�˵������ȷ���ǣ� ��

A. pH>2.7ʱ,��Һ��c(HR-)<c(R2-) B. ����b��ʾH2R�ķֲ�ϵ��
C. K1(H2R)��K2(H2R)=1000��1 D. pH=1.2ʱ,2c(R2-)+c(HR-)+c(OH-)=c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼Ԫ�������ǵ��ճ��������Ϳ�ѧ�о��ܲ��ɷ֡���ش��������⡣
(1)��ϩ����ˮ������Ĺ�Ч,��ϩ�ĵ���ʽ��______________��
(2)Al2O3���̼�Ȼ�ԭһ�Ȼ�����һ���µ���������,�÷����̶�,�豸��,����Ŀǰ�����ᳫ���ܼ��š����������Ĵ���
������ұ�������з����ķ�Ӧ�У�
(��)2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) ��H1;
(��)Al2O3(s)+Al4C3(s)+3AlCl3(g)=9AlCl(g)+3CO(g) ��H2;
(��)3AlCl(g)=AlCl3(g)+2Al(l) ��H3;
��Al2O3(s)+3C(s)= 2Al(l)+ 3CO(g) ��H4=___________________(�ú���H1����H2����H3�Ĵ���ʽ��ʾ)��
��Al4C3�����̼�Ȼ�ԭһ�Ȼ����������м�����������ˮ��Ӧ��������л���÷�Ӧ�Ļ�ѧ����ʽΪ__________________________________��
(3)���û���̿�Ļ�ԭ�Կɴ�����������β��(��������),�������·�ӦC(s)+2NO(g)![]() N2(g)+CO2(g) ��H��0��һ��������,�ܱ������е��й����ʵ�Ũ����ʱ��ı仯���±���ʾ��
N2(g)+CO2(g) ��H��0��һ��������,�ܱ������е��й����ʵ�Ũ����ʱ��ı仯���±���ʾ��
ʱ��/mim Ũ��/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 | 0.6 |
N2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
CO2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
��0~20min�ڵ�ƽ����Ӧ����v(CO2)=_______mol��L-1��min-1����һ�δﵽƽ���ƽ�ⳣ��K=__________��
��30minʱֻ�ı�ijһ��������ı������������______________ (����ĸ���)��
a�������¶� b�������¶� c����ͨ��һ������NO
d����С��������� e��������ʵĴ��� f�����������ݻ�
(4)����¯�з������ӵĻ�ѧ��Ӧ,���а�����Ӧ��C(s)+CO2(g)![]() 2CO(g)��H>0����1molCO2��������̼���뵽һ����ѹ�ܱ������У���ѹǿΪP�����ﵽƽ��ʱ,��������������������¶ȵĹ�ϵ����ͼ��
2CO(g)��H>0����1molCO2��������̼���뵽һ����ѹ�ܱ������У���ѹǿΪP�����ﵽƽ��ʱ,��������������������¶ȵĹ�ϵ����ͼ��

��CO2�������Ϊ86%ʱ,CO2��ת����Ϊ______________%(�������һλС��,��ͬ)��
����֪�������ѹP��=P������������������ﵽƽ��ʱ������ķ�ѹ��������Ũ������ʾ��ƽ�ⳣ��ΪKp,��900��ʱ,Kp=______________(�ú�p���Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽������֤���������ʣ�ij�о���ѧϰС����MnO2��Ũ����Ϊ��Ҫԭ�ϣ��������ͼ��ʾװ��(����a������ע������ͷ����Ƥ�ܣ���ͷ�Ѳ��벢������Ƥ��)�������о���
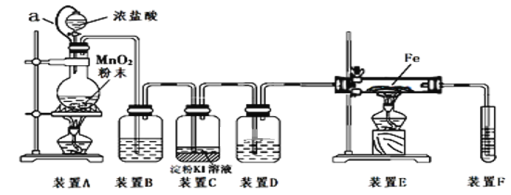
�����ϣ�����������Ӧ��ȡ�Ȼ���Ҫ����ˮ�����½��У�
�Իش��������⣺
��l��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ_____________________��
��2��װ��B�е��Լ�Ϊ_________��װ��D������________��
��3��װ��C�з�����Ӧ�����ӷ���ʽΪ_____________________________��
��4����Ӧ��ʼ��װ��E������Ӧ�Ļ�ѧ����ʽΪ____________________________��
��5��װ��F�з�����Ӧ�Ļ�ѧ����ʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����. ��ˮ�Ȼ����ǰ�ɫ���壬������ˮ�֣���178��������װ����ˮ�Ȼ������Լ�ƿ�����ڳ�ʪ�����У����Զ���ը�����������������Ȼ�������Ϊ�л��ϳɺ�ʯ��ҵ�Ĵ����������ڴ������͵ȣ���ҵ���ɽ��������������û�����ˮ�Ȼ������������ڽ����������Ƶã�
ij������ȤС����ʵ�����У�ͨ����ͼװ����ȡ������������ˮ�Ȼ�����
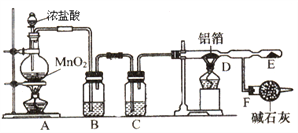
��1��Aװ���з�����Ӧ�����ӷ���ʽΪ_____________________________��
��2��B��Cװ����Ӧʢ�ŵ��Լ��ֱ�Ϊ______��______��
��3����Aװ�õ�����������������B��Cװ�ö�ֱ�ӽ���D�ܣ���ʵ������IJ��������___��
��4��Fװ�����������______��
��. ��һ��ɫ��Һ�����п��ܺ���Fe3+��Al3+��Fe2+��Mg2+��Cu2+��NH4+��K+��CO32����SO42�������ӵļ��֣�Ϊ������ɷ֣�ȡ����Һ�ֱ�������ĸ�ʵ�飬��������й���������ͼ1��ʾ��

��1����ԭ��Һ��һ�����ڵ�������______��
��2������ʵ���У���ȡԭ��Һ100mL���μ�NaOH��Һ�����ʵ���Ũ��Ϊ0.5molL��1 �������ɳ������������NaOH ������ͼ2��ʾ�������Һ�����������ӵ�Ũ��Ϊ_____molL��1��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com