
【题目】碳元素与人们的日常生活、生活和科学研究密不可分。请回答下列问题。
(1)乙烯具有水果催熟的功效,乙烯的电子式是______________。
(2)Al2O3真空碳热还原一氯化法是一种新的炼铝工艺,该法流程短,设备简单,符合目前国家提倡节能减排、改造升级的大环境。
①其中冶炼过程中发生的反应有:
(ⅰ)2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) △H1;
(ⅱ)Al2O3(s)+Al4C3(s)+3AlCl3(g)=9AlCl(g)+3CO(g) △H2;
(ⅲ)3AlCl(g)=AlCl3(g)+2Al(l) △H3;
则Al2O3(s)+3C(s)= 2Al(l)+ 3CO(g) △H4=___________________(用含△H1、△H2、△H3的代数式表示)。
②Al4C3是真空碳热还原一氯化法炼铝的中间产物,该物质与水反应生成最简单的有机物。该反应的化学方程式为__________________________________。
(3)利用活性炭的还原性可处理机动车的尾气(氮氧化物),发生如下反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度与时间的变化如下表所示:
N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度与时间的变化如下表所示:
时间/mim 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 | 0.6 |
N2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
CO2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
①0~20min内的平均反应速率v(CO2)=_______mol·L-1·min-1;第一次达到平衡的平衡常数K=__________。
②30min时只改变某一条件,则改变的条件可能是______________ (填字母编号)。
a.升高温度 b.降低温度 c.再通入一定量的NO
d.缩小容器的体积 e.加入合适的催化剂 f.增大容器休积
(4)炼钢炉中发生复杂的化学反应,其中包括反应:C(s)+CO2(g)![]() 2CO(g)△H>0。将1molCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。达到平衡时,容器内气体体积分数与温度的关系如下图:
2CO(g)△H>0。将1molCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。达到平衡时,容器内气体体积分数与温度的关系如下图:

①CO2体积分数为86%时,CO2的转化率为______________%(结果保留一位小数,下同)。
②已知:气体分压P分=P总×气体体积分数,达到平衡时用气体的分压代替气体浓度所表示的平衡常数为Kp,则900℃时,Kp=______________(用含p总的代数式表示)。
【答案】![]()
![]() △H1+
△H1+![]() △H2+△H3Al4C3+l2H2O=4Al(OH)3↓+3CH4↑0.04mol·L-1·min-14cd7.5%14.73p总
△H2+△H3Al4C3+l2H2O=4Al(OH)3↓+3CH4↑0.04mol·L-1·min-14cd7.5%14.73p总
【解析】
(1)由乙烯的成键特点可得其分子的电子式为:![]() (2)①由盖斯定律可得目标热化学方程式可由
(2)①由盖斯定律可得目标热化学方程式可由 ![]() ,则△H4=
,则△H4=![]() △H1+
△H1+![]() △H2+△H3,故答案为:△H4=
△H2+△H3,故答案为:△H4=![]() △H1+
△H1+![]() △H2+△H3;②Al4C3与水反应发生强烈的水解生成Al(OH)3和CH4,故答案为:Al4C3+l2H2O=4Al(OH)3↓+3CH4↑(3)①0~20min内NO的浓度变化2.0mol/L-0.4mol/L=1.6mol/L,则CO2的浓度增加为1.6mol/L÷2=0.8mol/L,其平均反应速率v(CO2)=0.8mol/L÷20min=0.04mol·L-1·min-1,由反应方程式可得该反应的平衡常数K=
△H2+△H3;②Al4C3与水反应发生强烈的水解生成Al(OH)3和CH4,故答案为:Al4C3+l2H2O=4Al(OH)3↓+3CH4↑(3)①0~20min内NO的浓度变化2.0mol/L-0.4mol/L=1.6mol/L,则CO2的浓度增加为1.6mol/L÷2=0.8mol/L,其平均反应速率v(CO2)=0.8mol/L÷20min=0.04mol·L-1·min-1,由反应方程式可得该反应的平衡常数K=![]() =
=![]() =4, 故答案为:0.04mol·L-1·min-1、4;②30min时改变某一条件后,在第二次达到平衡后平衡常数K=
=4, 故答案为:0.04mol·L-1·min-1、4;②30min时改变某一条件后,在第二次达到平衡后平衡常数K=![]() =4,和第一次平衡时相同,则改变的条件不可能是温度,且在新平衡下,各物质的浓度都变为原来的1.5倍,则改变的条件只能在其它条件不变时将体积压缩到原来的
=4,和第一次平衡时相同,则改变的条件不可能是温度,且在新平衡下,各物质的浓度都变为原来的1.5倍,则改变的条件只能在其它条件不变时将体积压缩到原来的![]() 或在其它条件不变时又充入一定量的NO(为原起始NO物质的量的0.5倍),故答案为:cd;(4)①设CO2的转化率为x,则剩余CO2为(1-x)mol,生成CO为2xmol,CO2的体积分数=
或在其它条件不变时又充入一定量的NO(为原起始NO物质的量的0.5倍),故答案为:cd;(4)①设CO2的转化率为x,则剩余CO2为(1-x)mol,生成CO为2xmol,CO2的体积分数=![]() =0.86,解得x≈0.075,故答案为:7.5%;②由题示信息可得Kp=
=0.86,解得x≈0.075,故答案为:7.5%;②由题示信息可得Kp=![]() =0.942 P2总÷0.06 P2总=14.73p总,故答案为:14.73p总。
=0.942 P2总÷0.06 P2总=14.73p总,故答案为:14.73p总。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”; ②“以曾青涂铁,铁赤色如铜”。下列有关叙述正确的是
A. ①中水银“积变又还成丹砂”说明水银发生了还原反应
B. ②中反应的离子方程式为:2Fe+3Cu2+=2Fe3++3Cu
C. 根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒
D. 水银能跟曾青发生置换反应生成单质铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见无机物A、B、C、D存在如图转化关系:
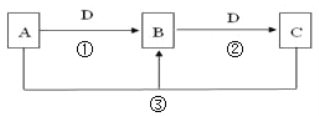
(1)若D是氯碱工业的主要产品,B有两性氢氧化物,则反应②的离子方程式是:______。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为__________________________________。
(3)若A为常见挥发性强酸,D是生产生活中用量最大用途最广的金属单质,,则B的化学式可能是________。
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则反应③的化学方程式_______。
(5)若A、B、C的水溶液均显碱性,焰色反应均为黄色,D为CO2,用离子方程式解释B溶液显碱性的原因(用离子方程式表示)__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、将 5 g 钠铝合金投入到 200 mL 的水中,固体完全溶解,产生 4.48 L 标准状况下的气体,溶液中只有一种溶质。经过分析得出钠铝合金中两种金属的物质的量之比为_______,所得溶液中溶质的物质的量浓度为__________(假设溶液体积变化忽略不计)。
Ⅱ、把由 NaOH、AlCl3、MgCl2 三种固体组成的混合物溶于足量水中,有 0.58 g 白色难溶物析出,向所 得溶液中逐滴加人 0.5 mol L-1 的盐酸,加入盐酸的体积和生成沉淀的质量如下图所示:

请计算:
(1)混合物中 MgCl2 的质量__________g;
(2)P 点表示盐酸加入的体积_________ml。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的相对分子质量为56。
(1)该烃的分子式为_________________________。
(2)若能使酸性KMnO4溶液褪色,则可能的结构简式为__________________________。
(3)上述(2)中的混合物与足量H2反应后,所得产物共有__________种。
(4)上述(2)中的混合物若与足量HBr反应后,所得产物共有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜晶体(CuSO4·xH2O)是一种用途广泛的试剂。某小组拟探究硫酸铜性质并测定其晶体中结晶水含量。
实验(一):探究硫酸铜的氧化性。
取适量硫酸铜溶液于试管,加入(NH4)2SO3溶液,产生沉淀M。过滤、洗涤、得M固体。为了探究M的组成,进行如下实验:
①取一定量M固体分成两份;
②在一份固体中加入稀硫酸,产生刺激性气味的气体X,将气体X通入溴水中,溴水褪色;溶液变成蓝色并有红色固体生成。
③在另一份固体中加入浓烧碱溶液,共热,产生的气体Y通入甲基橙溶液中,溶液变黄色。
(1)X的化学式是______________。
(2)经测定,M中阳离子、阴离子个数之比为2∶1。写出M与稀硫酸反应的化学方程式:____________。
实验(二):探究硫酸铜晶体的热稳定性。
他们取少量硫酸铜晶体进行实验,装置如图所示。
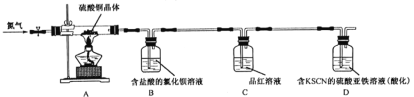
观察到的实验现象:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中无色溶液变红色溶液。
(3)B中用盐酸酸化的目的是______________;C中现象是__________________________________。
(4)D中有单质参加反应的离子方程式:________________________________________________。
实验(三):测定硫酸铜晶体中结晶水含量。
取wg硫酸铜晶体(CuSO4·xH2O)配制成250mL溶液,取20.00mL所配制溶液用cmol·L-1EDTA(简化为Na4Y)溶液滴定至终点,消耗EDTA滴定液休积为VmL。(滴定反应:Cu2++Y4-=CuY2-)
(5)x=_____________________(用代数式表示)。
(6)下列情况会使测得x值偏大的是______________(填字母)。
a.样品失去部分结晶水 b.滴定管未用EDTA溶液润洗
c.开始读数时滴定管尖嘴有气泡(终点时尖嘴无气泡) d.滴定终点时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)保持营养平衡,是保证身心健康、提高生活质量的有效手段。
①“中国居民平衡膳食宝塔”(见下图),位于第“⑤”层且每天不超过25g的能量物质是________(填字母)。
a.谷类 b.油脂 c.无机盐
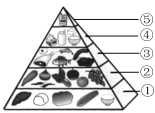
②我国居民在平时的饮食中应多吃碱性食物。下列食物属于碱性食物的是________(填字母)。
a.鱿鱼干 b.菠菜 c.苹果
③绿色植物通过下图储存能量,用化学方程式表示其光合作用的过程:____________________。

(2)材料是人类生存和发展的物质基础,合理使用材料可以改善人类生活。
①我国高速列车制造技术具有世界领先水平。高速列车制造要使用轻质金属材料。下列可以作为轻质金属材料的是________(填字母)。
a.铝合金 b.铁合金 c.碳纤维 d.硅纤维
②青铜在我国有悠久的历史,青铜的主要组成元素是铜和________(填元素符号)。青铜器表面容易生成一层薄薄的铜绿[主要成分是Cu2(OH)2CO3],请写出铜在潮湿的空气中发生电化学腐蚀时的正极反应式:_________________________________________。
③新型有机玻璃透光性好,质轻,耐酸、碱,易于加工成型,强度高,安全性好。有机玻璃属于________(填“合成纤维”“合成橡胶”或“塑料”)材料。特氟龙(聚四氟乙烯)可作为不粘锅涂层,写出该聚合物的结构简式:_____________________________。
(3)保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。
①煤炭直接燃烧引起多种环境问题。治理被酸雨侵蚀过的酸性土壤,可以加入适量的________(填字母)。
a.Ca(OH)2 b.KNO3 c.SiO2 d.CaCO3
②处理含CO、SO2烟道气污染的一种方法是将CO、SO2在催化剂作用下转化为单质硫,写出发生反应的化学方程式:_____________________________。
③据世界卫生组织报道,全世界75%左右的疾病与水体污染有关。污水处理方法很多,例如含氰(CN-)废水的处理,是在碱性条件下,向含氰废水中通入Cl2,可将CN-氧化为无毒的N2和CO2,使水质得到净化。写出该反应的离子方程式:_____________________________。
④消毒是饮用水处理中最重要的环节之一。近年来发展利用ClO2、O3消毒剂替代液氯,主要是人们发现液氯消毒会使水中的多种有机物发生变化,生成有害的物质如___________(填分子式)而可能致癌和致畸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,有以下三种:
部分氧化: CH4(g)+1/2O2(g) ![]() CO(g)+2H2(g) ΔH1= —35.9kJ·mol-1 ①
CO(g)+2H2(g) ΔH1= —35.9kJ·mol-1 ①
水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3= —41.2kJ·mol-1 ③
CO2(g)+H2(g) ΔH3= —41.2kJ·mol-1 ③
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH4 ④
2CO(g)+2H2(g) ΔH4 ④
则反应②自发进行的条件是________________,ΔH4 =_____________kJ·mol-1。
(2)起始向密闭容器中充入一定量的CH4(g)和O2(g),发生反应①。CH4(g)的平衡转化率与温度(T)和压强(P)的关系如图所示。
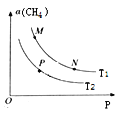
①N、P两点的平衡常数:K(N)_______K(P)(填“>”“<”或“=”),理由是_____________。
②M、N两点的H2的物质的量浓度c(M)____c(N)(填“>”“<”或“=”)。
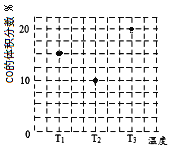
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) ![]() CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
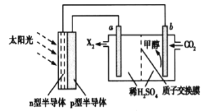
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等。则b极的电极反应式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com