
����Ŀ����������A��B��C��D������ͼת����ϵ��
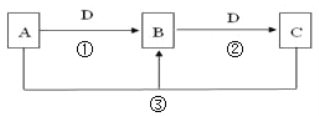
��1����D���ȼҵ����Ҫ��Ʒ��B���������������Ӧ�ڵ����ӷ���ʽ�ǣ�______��
��2����A��һ�ּ������壬�������������B������β��֮һ�����������ɫ����Ӧ�ٵĻ�ѧ����ʽΪ__________________________________��
��3����AΪ�����ӷ���ǿ�ᣬD���������������������;���Ľ������ʣ�����B�Ļ�ѧʽ������________��
��4����A��C��D���dz������壬C���γ��������Ҫ���壬��Ӧ�۵Ļ�ѧ����ʽ_______��
��5����A��B��C��ˮ��Һ���Լ��ԣ���ɫ��Ӧ��Ϊ��ɫ��DΪCO2�������ӷ���ʽ����B��Һ�Լ��Ե�ԭ�������ӷ���ʽ��ʾ��__________________________��
���𰸡�Al(OH)3+OH����AlO2�� + 2H2O��Al(OH)3 + OH����[Al(OH)4]��4NH3��5O2![]() 4NO��6H2OFe(NO3)32H2S+SO2��3S+2H2OCO32-+H2O
4NO��6H2OFe(NO3)32H2S+SO2��3S+2H2OCO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
��������
��1����D���ȼҵ����Ҫ��Ʒ���ȼҵ�ܲ�������������������������B�����ԣ���ת����ϵDΪNaOH��BΪAl��OH��3��CΪNaAlO2����Ӧ�ڵ����ӷ���ʽ�ǣ�Al��OH��3+OH���T[Al��OH��4]����Al(OH)3+OH����AlO2�� + 2H2O��
��2����A��һ�ּ������壬�������������Ϊ������B������β��֮һ�����������ɫ����B��NO��D��������C�Ƕ�����������Ӧ�ٵĻ�ѧ����ʽΪ4NH3+5O2![]() 4NO2+6H2O��
4NO2+6H2O��
��3����AΪ�����ӷ���ǿ�ᣬD���������������������;���Ľ������ʣ���D��Fe��B�ܺ�D��Ӧ����C����A�����ᡢB����������C��������������B�Ļ�ѧʽΪFe��NO3��3��
��4����A��C��D���dz������壬C���γ��������Ҫ���壬��C�Ƕ�������A�����⡢D��������B��S����Ӧ�۵Ļ�ѧ����ʽ2H2S+SO2�T3S+2H2O��
��5����A��B��C��ˮ��Һ���Լ��ԣ���ɫ��Ӧ��Ϊ��ɫ��˵��������NaԪ�أ�DΪCO2��AΪNaOH��B��̼���ơ�CΪ̼�����ƣ�BΪǿ�������Σ�̼�������ˮ�����Һ�ʼ��ԣ�ˮ�����ӷ���ʽΪCO32��+H2O![]() HCO3��+OH����
HCO3��+OH����


 Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д� Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ѧ��Fulvio Cacace���˻���˼��������о��������̬N4���ӣ�����ӽṹ����ͼ��ʾ����֪����1 mol N��N����167 kJ����������1 mol N![]() N�ų�942 kJ����������������Ϣ�����ݣ��ж�����˵����ȷ����
N�ų�942 kJ����������������Ϣ�����ݣ��ж�����˵����ȷ����

A��N4����һ�����͵Ļ�����
B��N4�����д��ڷǼ��Լ�
C��N4������N��N����Ϊ109��28��
D��1 mol N4ת���N2������882 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں����ܱ�������ͨ��X��������Ӧ��2X(g)![]() Y(g)���¶�T1��T2��X�����ʵ���Ũ��c(x)��ʱ��t�仯��������ͼ��ʾ������������ȷ���ǣ� ��
Y(g)���¶�T1��T2��X�����ʵ���Ũ��c(x)��ʱ��t�仯��������ͼ��ʾ������������ȷ���ǣ� ��
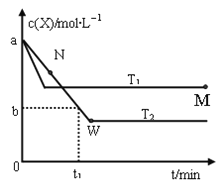
A. �÷�Ӧ���е�M��ų����������ڽ��е�W��ų�������
B. T2�£���0��t1ʱ���ڣ���(Y)��![]() mol/(L��min)
mol/(L��min)
C. M�������Ӧ���ʦ�������N����淴Ӧ���ʦ���
D. M��ʱ�ټ���һ������X��ƽ���X��ת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������п������������ϡ���ᷴӦ����������������m�뷴Ӧʱ��t�Ĺ�ϵͼ����������
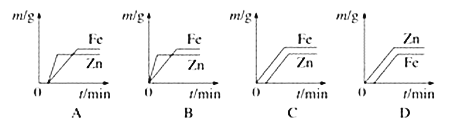
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��Һ���ܴ��������һ���ǣ�������
A.NH4+��Ag+��CO32����SO42��B.Fe3+��H+��NO3����Cl��
C.Fe3+��NH4+��I����Cl��D.H+��Mg2+��NO3����HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
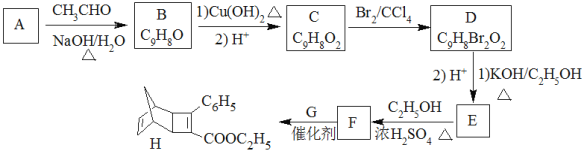
����Ŀ��������H��һ���л��������м��塣ʵ�����ɷ��㻯����A�Ʊ�H��һ�ֺϳ�·�����£�
��֪��
![]()
![]()
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ_____________________��
��2����C����D��E����F�ķ�Ӧ���ͷֱ�Ϊ__________��_________��
��3��E�Ľṹ��ʽΪ________________________��
��4��GΪ�ױ���ͬ���칹�壬��F����H�Ļ�ѧ����ʽΪ________________________��
��5�����㻯����X��F��ͬ���칹�壬X���뱥��̼��������Һ��Ӧ�ų�CO2����˴Ź���������ʾ��4�ֲ�ͬ��ѧ�������⣬�������Ϊ6��2��1��1��д��1�ַ���Ҫ���X�Ľṹ��ʽ_____________________________��
��6��д���û������2-��ȲΪԭ���Ʊ�������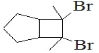 �ĺϳ�·��_______�������Լ���ѡ����
�ĺϳ�·��_______�������Լ���ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺
��1���� 28.5 g �Ȼ�þ����ˮ��ɵ� 500mL ��Һ�� Cl-Ũ����______________��д���Ȼ�þ�ĵ��뷽��ʽ_________________________________________________________��
��2���������� 50 g �� HCl��NH3��CO2��O2 �������壬����ͬ�¶Ⱥ���ͬѹǿ�����£����������____________��
��3������ 90 mL 0.1 mol/L CuSO4 ��Һ����Ҫ CuSO4��5H2O_______ g�����в�����ʹ������ҺŨ��ƫ�ߵ���__________________________��
A.����ƿϴ�Ӹɾ���δ���� B.���ݺ���ҡ�ȡ����ã�����Һ���½����ټ�����������ˮ
C.����ʱ���ӿ̶��� D.�ձ��Ͳ�����δϴ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼Ԫ�������ǵ��ճ��������Ϳ�ѧ�о��ܲ��ɷ֡���ش��������⡣
(1)��ϩ����ˮ������Ĺ�Ч,��ϩ�ĵ���ʽ��______________��
(2)Al2O3���̼�Ȼ�ԭһ�Ȼ�����һ���µ���������,�÷����̶�,�豸��,����Ŀǰ�����ᳫ���ܼ��š����������Ĵ���
������ұ�������з����ķ�Ӧ�У�
(��)2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) ��H1;
(��)Al2O3(s)+Al4C3(s)+3AlCl3(g)=9AlCl(g)+3CO(g) ��H2;
(��)3AlCl(g)=AlCl3(g)+2Al(l) ��H3;
��Al2O3(s)+3C(s)= 2Al(l)+ 3CO(g) ��H4=___________________(�ú���H1����H2����H3�Ĵ���ʽ��ʾ)��
��Al4C3�����̼�Ȼ�ԭһ�Ȼ����������м�����������ˮ��Ӧ��������л���÷�Ӧ�Ļ�ѧ����ʽΪ__________________________________��
(3)���û���̿�Ļ�ԭ�Կɴ�����������β��(��������),�������·�ӦC(s)+2NO(g)![]() N2(g)+CO2(g) ��H��0��һ��������,�ܱ������е��й����ʵ�Ũ����ʱ��ı仯���±���ʾ��
N2(g)+CO2(g) ��H��0��һ��������,�ܱ������е��й����ʵ�Ũ����ʱ��ı仯���±���ʾ��
ʱ��/mim Ũ��/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 | 0.6 |
N2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
CO2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
��0~20min�ڵ�ƽ����Ӧ����v(CO2)=_______mol��L-1��min-1����һ�δﵽƽ���ƽ�ⳣ��K=__________��
��30minʱֻ�ı�ijһ��������ı������������______________ (����ĸ���)��
a�������¶� b�������¶� c����ͨ��һ������NO
d����С��������� e��������ʵĴ��� f�����������ݻ�
(4)����¯�з������ӵĻ�ѧ��Ӧ,���а�����Ӧ��C(s)+CO2(g)![]() 2CO(g)��H>0����1molCO2��������̼���뵽һ����ѹ�ܱ������У���ѹǿΪP�����ﵽƽ��ʱ,��������������������¶ȵĹ�ϵ����ͼ��
2CO(g)��H>0����1molCO2��������̼���뵽һ����ѹ�ܱ������У���ѹǿΪP�����ﵽƽ��ʱ,��������������������¶ȵĹ�ϵ����ͼ��

��CO2�������Ϊ86%ʱ,CO2��ת����Ϊ______________%(�������һλС��,��ͬ)��
����֪�������ѹP��=P������������������ﵽƽ��ʱ������ķ�ѹ��������Ũ������ʾ��ƽ�ⳣ��ΪKp,��900��ʱ,Kp=______________(�ú�p���Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������ʽΪC8H18��һ�ȴ���ֻ��һ�ֵ�����������Ϊ________________��
��2�������Ľṹ��ͼ��ʾ�������ʽΪ___________����һ�ȴ�����_____�֣����ȴ�����_____�֡�
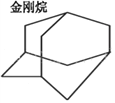
��3�������ϩ(CH2=C(CH3)CH=CH2)��˳ʽ�������ϩ�Ľṹ��ʽΪ_________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com