
【题目】按要求回答下列问题:
(1)将 28.5 g 氯化镁溶于水配成的 500mL 溶液中 Cl-浓度是______________,写出氯化镁的电离方程式_________________________________________________________。
(2)质量都是 50 g 的 HCl、NH3、CO2、O2 四种气体,在相同温度和相同压强条件下,体积最大的是____________。
(3)配制 90 mL 0.1 mol/L CuSO4 溶液,需要 CuSO4·5H2O_______ g,下列操作会使所配溶液浓度偏高的是__________________________。
A.容量瓶洗涤干净后未干燥 B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C.定容时俯视刻度线 D.烧杯和玻璃棒未洗涤
【答案】1.2mol/L MgCl2=Mg2++2Cl- NH3 2.5 C
【解析】
(1)依据n=![]() =cV,结合氯化镁是可溶性盐,在水溶液中完全电离,1mol氯化镁电离产生2mol氯离子解答;氯化镁为强电解质,完全电离;
=cV,结合氯化镁是可溶性盐,在水溶液中完全电离,1mol氯化镁电离产生2mol氯离子解答;氯化镁为强电解质,完全电离;
(2)相同温度和相同压强条件下,体积与物质的量成正比,结合n=![]() 可知,摩尔质量越大,n越小,则体积越小;
可知,摩尔质量越大,n越小,则体积越小;
(3)结合n=cV、m=nM计算;
根据c=![]() 可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化,若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏高。
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化,若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏高。
(1)将28.5g氯化镁溶于水配成的500mL溶液中Cl-浓度是:![]() ×2=1.2mol/L,
×2=1.2mol/L,
氯化镁的电离产生镁离子和氯离子,其电离方程式为:MgCl2=Mg2++2Cl-;
故答案为:1.2molL-1;MgCl2=Mg2++2Cl-;
(2)相同温度和相同压强条件下,体积与物质的量成正比,结合n=![]() 可知,摩尔质量越大,n越小,则体积越小,HCl(36.5g/mol)、NH3(17g/mol)、CO2(44g/mol)、O2(32g/mol)四种气体中,NH3的摩尔质量最小,则体积最大,
可知,摩尔质量越大,n越小,则体积越小,HCl(36.5g/mol)、NH3(17g/mol)、CO2(44g/mol)、O2(32g/mol)四种气体中,NH3的摩尔质量最小,则体积最大,
故答案为:NH3;
(3)配制90 mL 0.1 mol/L CuSO4 溶液,需要100mL容量瓶,需要CuSO4·5H2O质量为0.1L×0.1mol/L×250g/mol=2.5g,
故答案为:2.5g;
A.容量瓶洗涤干净后未干燥不影响,故A错误;
B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,溶液体积增加,浓度偏低,故B错误;
C.定容时俯视刻度线导致加入的蒸馏水体积偏小,根据c=![]() 可得,配制的溶液浓度偏高,故C正确;
可得,配制的溶液浓度偏高,故C正确;
D.烧杯和玻璃棒未洗涤,溶质的物质的量减少,浓度偏低,故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 向硫酸钠溶液中加入氯化钡溶液 | 硫酸铜溶液中插入铁片 | 向FeSO4溶液中滴入NaOH溶液 | 加热盛有浓硫酸和木炭的试管 |
现象 | 产生白色沉淀 | 铁片上出现红色物质 | 产生白色沉淀,迅速变成灰绿色,最终变为红褐色 | 产生刺激性气味的气体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是:
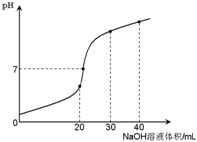
A. pH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
B. 当V(NaOH)=20mL时,溶液中水的电离程度比纯水大
C. 当V(NaOH)=30mL时,溶液中 c(SO42-)+ c(H+)= c(NH3·H2O) + c(OH-)
D. 滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见无机物A、B、C、D存在如图转化关系:
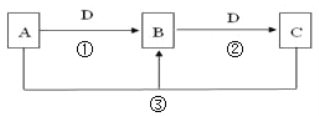
(1)若D是氯碱工业的主要产品,B有两性氢氧化物,则反应②的离子方程式是:______。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为__________________________________。
(3)若A为常见挥发性强酸,D是生产生活中用量最大用途最广的金属单质,,则B的化学式可能是________。
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则反应③的化学方程式_______。
(5)若A、B、C的水溶液均显碱性,焰色反应均为黄色,D为CO2,用离子方程式解释B溶液显碱性的原因(用离子方程式表示)__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是( )
A. 98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L
B. 当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1molL-1,只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1molL-1
C. 只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D. 50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、将 5 g 钠铝合金投入到 200 mL 的水中,固体完全溶解,产生 4.48 L 标准状况下的气体,溶液中只有一种溶质。经过分析得出钠铝合金中两种金属的物质的量之比为_______,所得溶液中溶质的物质的量浓度为__________(假设溶液体积变化忽略不计)。
Ⅱ、把由 NaOH、AlCl3、MgCl2 三种固体组成的混合物溶于足量水中,有 0.58 g 白色难溶物析出,向所 得溶液中逐滴加人 0.5 mol L-1 的盐酸,加入盐酸的体积和生成沉淀的质量如下图所示:

请计算:
(1)混合物中 MgCl2 的质量__________g;
(2)P 点表示盐酸加入的体积_________ml。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的相对分子质量为56。
(1)该烃的分子式为_________________________。
(2)若能使酸性KMnO4溶液褪色,则可能的结构简式为__________________________。
(3)上述(2)中的混合物与足量H2反应后,所得产物共有__________种。
(4)上述(2)中的混合物若与足量HBr反应后,所得产物共有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)保持营养平衡,是保证身心健康、提高生活质量的有效手段。
①“中国居民平衡膳食宝塔”(见下图),位于第“⑤”层且每天不超过25g的能量物质是________(填字母)。
a.谷类 b.油脂 c.无机盐
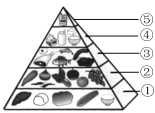
②我国居民在平时的饮食中应多吃碱性食物。下列食物属于碱性食物的是________(填字母)。
a.鱿鱼干 b.菠菜 c.苹果
③绿色植物通过下图储存能量,用化学方程式表示其光合作用的过程:____________________。

(2)材料是人类生存和发展的物质基础,合理使用材料可以改善人类生活。
①我国高速列车制造技术具有世界领先水平。高速列车制造要使用轻质金属材料。下列可以作为轻质金属材料的是________(填字母)。
a.铝合金 b.铁合金 c.碳纤维 d.硅纤维
②青铜在我国有悠久的历史,青铜的主要组成元素是铜和________(填元素符号)。青铜器表面容易生成一层薄薄的铜绿[主要成分是Cu2(OH)2CO3],请写出铜在潮湿的空气中发生电化学腐蚀时的正极反应式:_________________________________________。
③新型有机玻璃透光性好,质轻,耐酸、碱,易于加工成型,强度高,安全性好。有机玻璃属于________(填“合成纤维”“合成橡胶”或“塑料”)材料。特氟龙(聚四氟乙烯)可作为不粘锅涂层,写出该聚合物的结构简式:_____________________________。
(3)保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。
①煤炭直接燃烧引起多种环境问题。治理被酸雨侵蚀过的酸性土壤,可以加入适量的________(填字母)。
a.Ca(OH)2 b.KNO3 c.SiO2 d.CaCO3
②处理含CO、SO2烟道气污染的一种方法是将CO、SO2在催化剂作用下转化为单质硫,写出发生反应的化学方程式:_____________________________。
③据世界卫生组织报道,全世界75%左右的疾病与水体污染有关。污水处理方法很多,例如含氰(CN-)废水的处理,是在碱性条件下,向含氰废水中通入Cl2,可将CN-氧化为无毒的N2和CO2,使水质得到净化。写出该反应的离子方程式:_____________________________。
④消毒是饮用水处理中最重要的环节之一。近年来发展利用ClO2、O3消毒剂替代液氯,主要是人们发现液氯消毒会使水中的多种有机物发生变化,生成有害的物质如___________(填分子式)而可能致癌和致畸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com