
【题目】室温时,向20 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是:
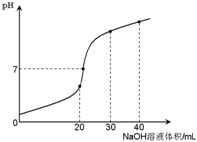
A. pH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
B. 当V(NaOH)=20mL时,溶液中水的电离程度比纯水大
C. 当V(NaOH)=30mL时,溶液中 c(SO42-)+ c(H+)= c(NH3·H2O) + c(OH-)
D. 滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1
【答案】C
【解析】试题分析:A、溶液中存在物料守恒:c(SO42-)=c(NH4+)+ c(NH3·H2O),电荷守恒:c(Na+)+c(NH4+)+c(H+)= c(OH-)+ 2c(SO42-),PH=7时,c(H+)= c(OH-),则c(Na+)+c(NH4+)=2c(SO42-),由于c(SO42-)>c(NH4+),则c(Na+)>c(SO42-),所以溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),A正确;B、当V(NaOH)=20mL时,生成硫酸铵和硫酸钠,铵根离子会发生水解,促进水的电离,则溶液中水的电离程度比纯水大,B正确;C、当V(NaOH)=30mL时,3c(SO42-)="2" c(Na+),根据电荷守恒:c(Na+)+c(NH4+)+c(H+)= c(OH-)+ 2c(SO42-),物料守恒:c(SO42-)=c(NH4+)+ c(NH3·H2O),整理得c(SO42-)+2 c(H+)=2c(NH3·H2O) + 2c(OH-),C错误;D、假设滴加NaOH溶液vml,c(Na+)+c(SO42-)=(0.1×20+0.1×v)/(20+v)=0.1mol/L,D正确。答案选C。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室中常用二氧化锰与浓盐酸共热制取氯气。某化学兴趣小组为制取较为纯净、干燥的氯气设计了如下实验装置。

请按要求回答下列问题:
(1)仪器X的名称为_________________。
(2)已知装置B中选用的试剂为饱和食盐水,其作用为 __________________。
(3)将氯气通入C中的紫色石蕊试液,可以观察到的现象是________________________。
(4)装置E中装有NaOH溶液,该装置中反应的化学方程式 ________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:

①、③均观察到实验现象:溶液呈蓝色,试管口有红棕色气体产生。下列说法正确的是
A. ①试管口有红棕色气体产生,原因是硝酸被还原为NO2
B. 由③的现象可得出结论:Cu可与稀硫酸反应
C. ③中反应的离子方程式:3Cu+2NO3-+8H+ === 3Cu2++2NO↑+4H2O
D. ③中可能产生SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
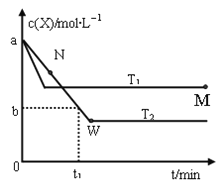
A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C. M点的正反应速率υ正大于N点的逆反应速率υ逆
D. M点时再加入一定量的X,平衡后X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中,氧化反应与还原反应在同种元素中进行的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
B.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中能大量共存的一组是( )
A.NH4+、Ag+、CO32﹣、SO42﹣B.Fe3+、H+、NO3﹣、Cl﹣
C.Fe3+、NH4+、I﹣、Cl﹣D.H+、Mg2+、NO3﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)将 28.5 g 氯化镁溶于水配成的 500mL 溶液中 Cl-浓度是______________,写出氯化镁的电离方程式_________________________________________________________。
(2)质量都是 50 g 的 HCl、NH3、CO2、O2 四种气体,在相同温度和相同压强条件下,体积最大的是____________。
(3)配制 90 mL 0.1 mol/L CuSO4 溶液,需要 CuSO4·5H2O_______ g,下列操作会使所配溶液浓度偏高的是__________________________。
A.容量瓶洗涤干净后未干燥 B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C.定容时俯视刻度线 D.烧杯和玻璃棒未洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4· 2H2O)是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
I、制备草酸亚铁晶体:
① 称取硫酸亚铁铵晶体5 g,放入250 mL三颈烧瓶中,加入10滴左右1.0 mol·L-1 H2SO4溶液和15 mL蒸馏水加热溶解;
② 加入25 mL饱和草酸溶液,加热搅拌至沸,停止加热,静置;
③ 待黄色晶体FeC2O42H2O沉淀后倾析,洗涤,加入约20 mL蒸馏水搅拌并温热5 min,静置,弃去上层清液,即得黄色草酸亚铁晶体。

回答下列问题:
(1)仪器C的名称是_____________;仪器B的作用是_____________
(2) 硫酸亚铁铵晶体用硫酸溶解的原因是_____________________
(3)硫酸亚铁铵晶体可能混有一定Fe3+,羟胺(NH2OH,酸性条件下以NH3OH+形式存在)具有强还原性,可用羟胺去除亚铁盐中的Fe3+。写出相关的离子方程式___________________________________
II、探究草酸亚铁的纯度:
① 准确称取m g草酸亚铁固体样品(含有草酸铵杂质),溶于25 mL 2 mol·L-1H2SO4溶液中,在60~80℃水浴加热,用100 mL容量瓶配成100.00 mL溶液;
② 取上述溶液20.00 mL,用KMnO4标准溶液(浓度为c mol·L-1)滴定三次,平均消耗V1 mL;
③ 加入适量锌粉和2 mL 2 mol·L-1 H2SO4溶液,反应一段时间后,取1滴试液放在点滴板上检验,至Fe3+极微量;
④ 过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约2~3 mL 2 mol·L-1 H2SO4溶液,继续用KMnO4标准溶液(浓度为c mol·L-1)滴定至终点,共平行测定三次,平均消耗V2 mL。
回答下列问题:
(4)在②中溶液中发生MnO4—+8H++5Fe2+==5Fe3++Mn2++4H2O,还有另一氧化还原反应,写出其离子方程式_____________________________________,用KMnO4标准溶液滴定至终点的现象是________________________________________
(5)加入适量锌粉的目的是______________________________________;步骤③中检验其中微量的Fe3+的试剂名称是______________溶液
(6)计算m g固体样品的纯度为______________(用含c、V1、V2的式子表示,不必化简)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com