
【题目】草酸亚铁晶体(FeC2O4· 2H2O)是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
I、制备草酸亚铁晶体:
① 称取硫酸亚铁铵晶体5 g,放入250 mL三颈烧瓶中,加入10滴左右1.0 mol·L-1 H2SO4溶液和15 mL蒸馏水加热溶解;
② 加入25 mL饱和草酸溶液,加热搅拌至沸,停止加热,静置;
③ 待黄色晶体FeC2O42H2O沉淀后倾析,洗涤,加入约20 mL蒸馏水搅拌并温热5 min,静置,弃去上层清液,即得黄色草酸亚铁晶体。

回答下列问题:
(1)仪器C的名称是_____________;仪器B的作用是_____________
(2) 硫酸亚铁铵晶体用硫酸溶解的原因是_____________________
(3)硫酸亚铁铵晶体可能混有一定Fe3+,羟胺(NH2OH,酸性条件下以NH3OH+形式存在)具有强还原性,可用羟胺去除亚铁盐中的Fe3+。写出相关的离子方程式___________________________________
II、探究草酸亚铁的纯度:
① 准确称取m g草酸亚铁固体样品(含有草酸铵杂质),溶于25 mL 2 mol·L-1H2SO4溶液中,在60~80℃水浴加热,用100 mL容量瓶配成100.00 mL溶液;
② 取上述溶液20.00 mL,用KMnO4标准溶液(浓度为c mol·L-1)滴定三次,平均消耗V1 mL;
③ 加入适量锌粉和2 mL 2 mol·L-1 H2SO4溶液,反应一段时间后,取1滴试液放在点滴板上检验,至Fe3+极微量;
④ 过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约2~3 mL 2 mol·L-1 H2SO4溶液,继续用KMnO4标准溶液(浓度为c mol·L-1)滴定至终点,共平行测定三次,平均消耗V2 mL。
回答下列问题:
(4)在②中溶液中发生MnO4—+8H++5Fe2+==5Fe3++Mn2++4H2O,还有另一氧化还原反应,写出其离子方程式_____________________________________,用KMnO4标准溶液滴定至终点的现象是________________________________________
(5)加入适量锌粉的目的是______________________________________;步骤③中检验其中微量的Fe3+的试剂名称是______________溶液
(6)计算m g固体样品的纯度为______________(用含c、V1、V2的式子表示,不必化简)
【答案】恒压滴液漏斗冷凝回流抑制Fe2+的水解2NH3OH++ 2Fe3+ ==2Fe2+ +N2↑+2H2O+ 4H+2MnO4-+5H2C2O4+6H+==2Mn2++10CO2↑+8H2O最后一滴标准溶液加入后,锥形瓶中的溶液颜色由黄色变为淡紫红色,且半分钟内不褪色将Fe3+还原为Fe2+硫氰化钾![]()
【解析】
(1)根据装置图可知,仪器C的名称是恒压滴液漏斗;仪器B是冷凝管,其作用是冷凝回流;(2)为了抑制Fe2+的水解,硫酸亚铁铵晶体用硫酸溶解;(3)利用羟胺的还原性,可以除去含Fe2+中的Fe3+,氧化产物是一种性质稳定、无污染的气体,则该气体是氮气,铁离子被还原为亚铁离子,其余产物可根据质量守恒、电荷守恒得出,离子方程式为2NH2OH+2Fe3+= 2Fe2++N2↑+2H2O+2H+;(4)在②中溶液中还含有草酸,草酸被高锰酸钾氧化,发生反应的离子方程式为2MnO4—+5H2C2O4+6H+==2Mn2++10CO2↑+8H2O,用KMnO4标准溶液滴定至终点的现象是最后一滴标准溶液加入后,锥形瓶中的溶液颜色由黄色变为淡紫红色,且半分钟内不褪色;(5)加入适量锌粉的目的是将Fe3+还原为Fe2+;步骤③中检验其中微量的Fe3+的试剂名称是硫氰化钾溶液,若滴入硫氰化钾溶液时溶液变为血红色则含有Fe3+;(6)根据反应MnO4—+8H++5Fe2+==5Fe3++Mn2++4H2O可知,m g固体样品的纯度为![]() 。
。


科目:高中化学 来源: 题型:
【题目】室温时,向20 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是:
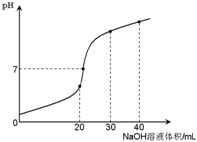
A. pH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
B. 当V(NaOH)=20mL时,溶液中水的电离程度比纯水大
C. 当V(NaOH)=30mL时,溶液中 c(SO42-)+ c(H+)= c(NH3·H2O) + c(OH-)
D. 滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的相对分子质量为56。
(1)该烃的分子式为_________________________。
(2)若能使酸性KMnO4溶液褪色,则可能的结构简式为__________________________。
(3)上述(2)中的混合物与足量H2反应后,所得产物共有__________种。
(4)上述(2)中的混合物若与足量HBr反应后,所得产物共有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
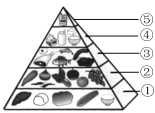
【题目】(1)保持营养平衡,是保证身心健康、提高生活质量的有效手段。
①“中国居民平衡膳食宝塔”(见下图),位于第“⑤”层且每天不超过25g的能量物质是________(填字母)。
a.谷类 b.油脂 c.无机盐
②我国居民在平时的饮食中应多吃碱性食物。下列食物属于碱性食物的是________(填字母)。
a.鱿鱼干 b.菠菜 c.苹果
③绿色植物通过下图储存能量,用化学方程式表示其光合作用的过程:____________________。

(2)材料是人类生存和发展的物质基础,合理使用材料可以改善人类生活。
①我国高速列车制造技术具有世界领先水平。高速列车制造要使用轻质金属材料。下列可以作为轻质金属材料的是________(填字母)。
a.铝合金 b.铁合金 c.碳纤维 d.硅纤维
②青铜在我国有悠久的历史,青铜的主要组成元素是铜和________(填元素符号)。青铜器表面容易生成一层薄薄的铜绿[主要成分是Cu2(OH)2CO3],请写出铜在潮湿的空气中发生电化学腐蚀时的正极反应式:_________________________________________。
③新型有机玻璃透光性好,质轻,耐酸、碱,易于加工成型,强度高,安全性好。有机玻璃属于________(填“合成纤维”“合成橡胶”或“塑料”)材料。特氟龙(聚四氟乙烯)可作为不粘锅涂层,写出该聚合物的结构简式:_____________________________。
(3)保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。
①煤炭直接燃烧引起多种环境问题。治理被酸雨侵蚀过的酸性土壤,可以加入适量的________(填字母)。
a.Ca(OH)2 b.KNO3 c.SiO2 d.CaCO3
②处理含CO、SO2烟道气污染的一种方法是将CO、SO2在催化剂作用下转化为单质硫,写出发生反应的化学方程式:_____________________________。
③据世界卫生组织报道,全世界75%左右的疾病与水体污染有关。污水处理方法很多,例如含氰(CN-)废水的处理,是在碱性条件下,向含氰废水中通入Cl2,可将CN-氧化为无毒的N2和CO2,使水质得到净化。写出该反应的离子方程式:_____________________________。
④消毒是饮用水处理中最重要的环节之一。近年来发展利用ClO2、O3消毒剂替代液氯,主要是人们发现液氯消毒会使水中的多种有机物发生变化,生成有害的物质如___________(填分子式)而可能致癌和致畸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1 NaOH溶液分别滴定100 mL 0.1 mol·L-1 HA、HB两种酸溶液。pH随NaOH溶液体积如下图所示,下列判断错误的是
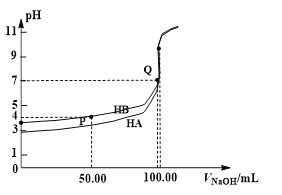
A. 电离常数:Ka(HA) > Ka(HB)
B. Ka(HB)≈10-4
C. pH=7时,c(A—)=c(B—)
D. 中和分数达100%时,HA溶液中存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成。请回答下列问题:
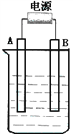
(1)请写出B极板的名称及反应式:_________ ___________________ 。
(2)写出电解时反应的总离子方程式__________________________________________ 。
(3)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。电解后溶液的pH为____________ ;要使电解后溶液恢复到电解前的状态,则需加入__________ ,其质量为______________g。(假设电解前后溶液的体积不变)
(4)若原溶液为1L K2SO4、CuSO4的混合溶液,且c(SO42-)= 2.0mol/L;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解。则原溶液中的c(K+)为 _______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com