
����Ŀ������ͼ��ʯī���缫�ĵ����У�����500mL��һ�����ʵ�ij��ɫ��Һ���е�⣬�۲쵽A�缫�����к�ɫ�Ĺ�̬�������ɣ�B�缫����ɫ�������ɡ���ش��������⣺
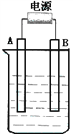
��1����д��B��������Ƽ���Ӧʽ��_________ ___________________ ��
��2��д�����ʱ��Ӧ�������ӷ���ʽ__________________________________________ ��
��3��������Һ�е�ԭ��������ȫ����ֹͣ��⣬ȡ��A�缫��ϴ�ӡ�����������缫����1.6g��������Һ��pHΪ____________ ��Ҫʹ������Һ�ָ������ǰ��״̬���������__________ ��������Ϊ______________g����������ǰ����Һ��������䣩
��4����ԭ��ҺΪ1L K2SO4��CuSO4�Ļ����Һ����c��SO42-��= 2.0mol/L����ͼװ�õ�⣬���������ռ���22.4L���壨��״����ʱ��ֹͣ��⡣��ԭ��Һ�е�c(K+)Ϊ _______
���𰸡� ���� 4OH--4e-=2H2O+O2�� 2Cu2++2H2O![]() 2Cu+O2��+4H+ 1 CuO 2 2mol/L
2Cu+O2��+4H+ 1 CuO 2 2mol/L
����������ɫ��Һ˵������ͭ���ӣ���ʯī���缫���ͭ����Һʱ��A�缫�����ɵĺ�ɫ��̬����ӦΪͭ����������AΪ��������BΪ����������������ɫ�������ɣ�˵��B�缫�����������ӷŵ磬�����ҺΪͭ�ĺ���������Һ��
��1��BΪ����������������ʧ���ӷ���������Ӧ�����������缫��ӦʽΪ��4OH--4e-=2H2O+O2����
��2�����ʱ��������ͭ���ӷŵ硢������ˮ�����������ӷŵ磬���Ե��ʱ��Ӧ�������ӷ���ʽΪ��2Cu2++2H2O![]() 2Cu+O2��+4H+��
2Cu+O2��+4H+��
��3��AΪ������������ԭ��Ӧ��A�缫����1.6gΪ����Cu�����������ʵ���Ϊ��1.6g��64g/mol=0.025mol�����ݵ�ط�Ӧ2Cu2++2H2O![]() 2Cu+O2��+4H+�ɵã�����H+�����ʵ���Ϊ��0.05mol����c(H+)=0.05mol��0.5L=0.1mol/L������pH=-lgc(H+)=1����������O2����������Cu������ԭ���غ㣬Cuԭ�Ӻ�Oԭ�Ӽ��ٵı���Ϊ1��1������Ҫʹ������Һ�ָ������ǰ��״̬���ɼ���CuO������Cuԭ���غ��n(CuO)=n(Cu)=0.025mol����m(CuO)=0.025mol��80g/mol=2g��
2Cu+O2��+4H+�ɵã�����H+�����ʵ���Ϊ��0.05mol����c(H+)=0.05mol��0.5L=0.1mol/L������pH=-lgc(H+)=1����������O2����������Cu������ԭ���غ㣬Cuԭ�Ӻ�Oԭ�Ӽ��ٵı���Ϊ1��1������Ҫʹ������Һ�ָ������ǰ��״̬���ɼ���CuO������Cuԭ���غ��n(CuO)=n(Cu)=0.025mol����m(CuO)=0.025mol��80g/mol=2g��
��4�����Ե缫���1LK2SO4��CuSO4�Ļ����Һ���������ռ�����״��22.4L���壨��������1mol����������������������Ӧ��4OH--4e-=2H2O+O2��������������Ӧ��Cu2++2e-=Cu��2H++2e-=H2�������ݵ�ʧ�����غ���n(H2)��2+n(Cu)��2=n(O2)��4����1mol��2+n(Cu)��2=1mol��4�����n(Cu)=1mol�����ݵ���غ�ɵ���n(K+)=2n(SO42-)-2n(Cu2+)=2��2.0mol/L��1L-2��1mol=2mol������c(K+)=2mol��1L=2mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��Һ���ܴ��������һ���ǣ�������
A.NH4+��Ag+��CO32����SO42��B.Fe3+��H+��NO3����Cl��
C.Fe3+��NH4+��I����Cl��D.H+��Mg2+��NO3����HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���������ڿ������ܱ����������������ơ�ij��ȤС��Ϊ�����������ƹ����Ƿ���ʼ�̽��������������ʣ����������ʵ��:

I������Na2SO3�Ƿ����
��1����Բ����ƿA�м������Һ1.0 mol/LNa2SO3��Һ50mL��ҺaΪ_______����ҺbΪ_______��
��2����װ��A�еμ�������Һa��Na2SO3��Ӧ��ȫ����װ��AʹSO2��ȫ�ݳ���ʵ��ǰ����Cװ������2.4g����Na2SO3��Һ���ʵ���Ũ��Ϊ_______mol/L�����ж�Na2SO3�����Ƿ����______�����ǻ����

II����������װ���Ʊ�����SO2�����ʵ��Ƚ�H2SO3�� H2CO3��H2SiO3������ǿ������̽��SO2�Ļ�ѧ���ʡ�
��1���Լ�X��___________���Լ�Y��___________���Լ�Z��___________��
��2���ر�ֹˮ��b����ֹˮ��a����װ����ͨ��SO2�����۲쵽_________����֤��H2CO3���Ա�H2SiO3ǿ��
��3���ر�ֹˮ��a����ֹˮ��b������ͨ��SO2����ˮ��ɫ��˵��SO2����_______��д����Ӧ�����ӷ���ʽ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������(FeC2O4�� 2H2O)��һ�ֻ�ɫ������ˮ�Ĺ��壬�����ֽ⣬������﮵�ء�Ϳ�ϡ���ɫ���Լ��й���ϵ�ԭ���ϡ�
I���Ʊ������������壺
�� ��ȡ��������茶���5 g������250 mL������ƿ�У�����10������1.0 mol��L-1 H2SO4��Һ��15 mL����ˮ�����ܽ⣻
�� ����25 mL���Ͳ�����Һ�����Ƚ������У�ֹͣ���ȣ����ã�
�� ����ɫ����FeC2O42H2O������������ϴ�ӣ�����Լ20 mL����ˮ���貢����5 min�����ã���ȥ�ϲ���Һ�����û�ɫ�����������塣

�ش��������⣺
��1������C��������_____________������B��������_____________
��2�� ��������茶����������ܽ��ԭ����_____________________
��3����������茶�����ܻ���һ��Fe3+���ǰ�(NH2OH��������������NH3OH+��ʽ����)����ǿ��ԭ�ԣ������ǰ�ȥ���������е�Fe3+��д����ص����ӷ���ʽ___________________________________
II��̽�����������Ĵ��ȣ�
�� ȷ��ȡm g��������������Ʒ(���в��������)������25 mL 2 mol��L-1H2SO4��Һ�У���60~80��ˮԡ���ȣ���100 mL����ƿ���100.00 mL��Һ��
�� ȡ������Һ20.00 mL����KMnO4����Һ(Ũ��Ϊc mol��L-1)�ζ����Σ�ƽ������V1 mL��
�� ��������п�ۺ�2 mL 2 mol��L-1 H2SO4��Һ����Ӧһ��ʱ���ȡ1����Һ���ڵ�ΰ��ϼ��飬��Fe3+������
�� ���˳�ȥп�ۣ���Һ�ռ�����һ����ƿ�У�����ֽ����������ϴ�ӣ�ϴ��Һ������Һ�У��ٲ���Լ2~3 mL 2 mol��L-1 H2SO4��Һ��������KMnO4����Һ(Ũ��Ϊc mol��L-1)�ζ����յ㣬��ƽ�вⶨ���Σ�ƽ������V2 mL��
�ش��������⣺
��4���ڢ�����Һ�з���MnO4��+8H++5Fe2+==5Fe3++Mn2++4H2O��������һ������ԭ��Ӧ��д�������ӷ���ʽ_____________________________________����KMnO4����Һ�ζ����յ��������________________________________________
��5����������п�۵�Ŀ����______________________________________��������м�����������Fe3+���Լ�������______________��Һ
��6������m g������Ʒ�Ĵ���Ϊ______________(�ú�c��V1��V2��ʽ�ӱ�ʾ�����ػ���)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��aA��g��+bB��g��![]() cC��g��+dD��g��������ͼ�ش�
cC��g��+dD��g��������ͼ�ش�

��1��ѹǿp1��p2 �����С����
��2����a+b���ȣ�c+d�� �����С����
��3���¶�t1��t2�� ����ߡ��͡���
��4������ӦΪ �ȷ�Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������ʽΪC8H18��һ�ȴ���ֻ��һ�ֵ�����������Ϊ________________��
��2�������Ľṹ��ͼ��ʾ�������ʽΪ___________����һ�ȴ�����_____�֣����ȴ�����_____�֡�
��3�������ϩ(CH2=C(CH3)CH=CH2)��˳ʽ�������ϩ�Ľṹ��ʽΪ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. �ữNaIO3��NaI�Ļ����Һ��I +IO3+6H+![]() I2+3H2O
I2+3H2O
B. ����Na2CO3��Һ��CaSO4���巴Ӧ��CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
C. KClO������Һ��Fe(OH)3��Ӧ��3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. ��ⱥ��ʳ��ˮ��2Cl+2H+![]() Cl2��+ H2��
Cl2��+ H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ka(HCOOH)=1.77��104��Ka(CH3COOH)=1.75��105��Kb(NH3��H2O) =1.75��105������˵����ȷ����
A. ��ͬ���pH��Ϊ3��HCOOH��CH3COOH��Һ���к�NaOH��������ͬ
B. 0.2 mol��L-1 HCOOH��0.1 mol��L-1 NaOH �������Ϻ�c(HCOO) + c(OH) < c(HCOOH) + c(H+)
C. Ũ�Ⱦ�Ϊ0.1 mol��L1�� HCOONa��NH4Cl ��Һ�������ӵ����ʵ���Ũ��֮�ͣ�ǰ�ߴ��ں���
D. ��CH3COONa��Һ��20��������30�棬��Һ��![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ���ĸ�ԭ���װ�ã����н�����ȷ����(����)

A. �٢���Mg��Ϊ�������ۢ���Fe��Ϊ����
B. ����Mg��Ϊ�������缫��ӦʽΪ6H2O��6e��===6OH����3H2��
C. ����Fe��Ϊ�������缫��ӦʽΪFe��2e��===Fe2��
D. ����Cu��Ϊ�������缫��ӦʽΪ2H����2e��===H2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com