
【题目】下列指定反应的离子方程式正确的是
A. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
B. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是( )
A. 98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L
B. 当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1molL-1,只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1molL-1
C. 只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D. 50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1 NaOH溶液分别滴定100 mL 0.1 mol·L-1 HA、HB两种酸溶液。pH随NaOH溶液体积如下图所示,下列判断错误的是
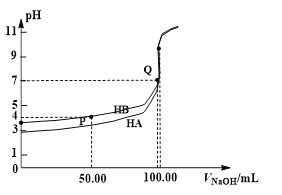
A. 电离常数:Ka(HA) > Ka(HB)
B. Ka(HB)≈10-4
C. pH=7时,c(A—)=c(B—)
D. 中和分数达100%时,HA溶液中存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成。请回答下列问题:
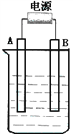
(1)请写出B极板的名称及反应式:_________ ___________________ 。
(2)写出电解时反应的总离子方程式__________________________________________ 。
(3)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。电解后溶液的pH为____________ ;要使电解后溶液恢复到电解前的状态,则需加入__________ ,其质量为______________g。(假设电解前后溶液的体积不变)
(4)若原溶液为1L K2SO4、CuSO4的混合溶液,且c(SO42-)= 2.0mol/L;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解。则原溶液中的c(K+)为 _______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的转化:
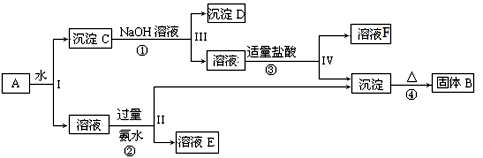
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是______。
(2)根据上图反应关系,写出下列B、F所含物质成分的化学式:B______;F_____。
(3)写出过程反应①的离子方程式_________________,固体B所含对应的金属其单质与磁性氧化铁在高温下反应的化学方程式__________________________。
(4)写出③中盐酸过量时的离子反应方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯。苯甲酸乙酯(密度1.05 g·cm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等。制备苯甲酸乙酯的过程如下:
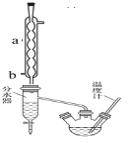
(1)制备粗产品:如图所示装置中,于50 mL圆底烧瓶中加入8.0 g苯甲酸(Mr=122)、20 mL乙醇(Mr=46,密度0.79 g·cm-3)、15 mL环己烷、3 mL浓硫酸,摇匀,加沸石。在分水器中加水,接通冷凝水,水浴回流约2 h,反应基本完成。记录体积,继续蒸出多余环己烷和醇(从分水器中放出)。
(2)粗产品纯化:加水30 mL,分批加入固体NaHCO3,分液,然后水层用20 mL石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210~213 ℃馏分。
相关数据如下:
沸点(℃,1 atm) | ||||||
苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物(环己烷—水—乙醇) |
249 | 212.6 | 40~80 | 100 | 78.3 | 80.75 | 62.6 |
根据以上信息和装置图回答下述实验室制备有关问题:
(1)写出制备苯甲酸乙酯反应的化学方程式______________________________________,仪器a的名称______________,b口为冷凝水的_____________(填“进水口”或“出水口”)。
(2)请说出在本实验中可以采取的能提高苯甲酸乙酯产率的方法_________________(写出任意一种即可)。
(3)如何利用实验现象判断反应已基本完成______________________________________。
(4)固体NaHCO3的作用______________________________,加入固体NaHCO3时的实验操作所用到的主要玻璃仪器为____________________。
(5)经精馏得210~213℃馏分7.0 mL,则实验中苯甲酸乙酯的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是

A. 甲装置:可用来证明碳酸的酸性比硅酸强
B. 乙装置:橡皮管的作用是能使水顺利流下
C. 丙装置:用图示的方法不能检查此装置的气密性
D. 丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com