
����Ŀ���ǽ�������A����ͼ��ʾ�Ĺ���ת��Ϊ������D����֪DΪǿ�ᣬ��ش��������⡣
![]()
![]()
![]()
![]()
![]()
![]()
![]()
��1����A�ڳ�����Ϊ���壬B����ʹƷ����Һ��ɫ���д̼�����ζ����ɫ����:
��D�Ļ�ѧʽ��________��
���ڹ�ҵ�����У�B����Ĵ����ŷű���ˮ���պ��γ���________����Ⱦ�˻�����
��2����A�ڳ�����Ϊ���壬C�Ǻ���ɫ������:
��A��C�Ļ�ѧʽ�ֱ��ǣ�A________��C________��
��D��Ũ��Һ�ڳ����¿���ͭ��Ӧ������C���壬��д���÷�Ӧ�Ļ�ѧ����ʽ_______________________________________________���÷�Ӧ________(����������������������)������ԭ��Ӧ��
 �����ÿ�ʱѵ��ϵ�д�
�����ÿ�ʱѵ��ϵ�д� ��Ԫȫ��������ϵ�д�
��Ԫȫ��������ϵ�д� �»ƸԱ����ܾ�ϵ�д�
�»ƸԱ����ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ���������Ϊ��ѧ��ѧ�����Ĵ��������֮������ͼ��ʾ�ķ�Ӧ��ϵ�����������鲻��������ת����ϵ����( )
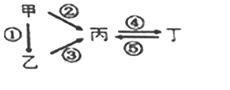
ѡ�� | �� | �� | �� | �� |
A | N2 | NH3 | NO | NO2 |
B | Si | SiO2 | Na2SiO3 | Na2CO3 |
C | S | H2S | SO3 | H2SO4 |
D | Al | Al2O3 | NaAlO2 | Al��OH��3 |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ�л���뷽��ʽ��ȷ����
A. Fe2��SO4��3��Һ�м�������Ba��OH��2��Һ��Fe3++SO42-+Ba2++3OH-=Fe��OH��3��+BaSO4��
B. ��NaHSO4��Һ�м���Ba��OH��2��Һ��SO42-��ȫ������ 2H++SO42-+2OH-+Ba2+=2H2O+BaSO4��
C. ��̼�������Һ�м�������������ƣ�Ca2++HCO3-+OH-=CaCO3��+H2O
D. HSO3-��ˮ�еĵ��룺HSO3-+H2O![]() SO32-+ H3O+
SO32-+ H3O+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ε�س䡢�ŵ�Ļ�ѧ����ʽΪ2K2S2+KI3![]() K2S4+3KI�������������豸���ӵĵ�·��ͼ��ʾ�����պϿ���Kʱ���缫X������Һ�ȱ�졣������˵����ȷ����
K2S4+3KI�������������豸���ӵĵ�·��ͼ��ʾ�����պϿ���Kʱ���缫X������Һ�ȱ�졣������˵����ȷ����
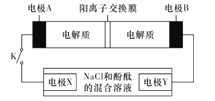
A. �ŵ�ʱ���缫A������ԭ��Ӧ
B. �缫A�ĵ缫��ӦʽΪ3I--2e-=I3-
C. ����0.1mol K+ͨ�������ӽ���Ĥʱ���缫X�ϲ�������1.12 L(��״����)
D. ��س��ʱ���缫BҪ�����Դ�������������缫�Ϸ�����ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л������NaOH����H2SO4����CH3COOH����NaCl����CH3COONa����NH4Cl����CH3COONH4����NH4H2SO4����NH3��H2O����ش��������⣺
��1����Ũ�Ⱦ�Ϊ0.1mol��L-1���������NaOH��NH3��H2O�ֱ��ˮϡ��m����n����
ϡ�ͺ�������Һ��pH�����9����m_______n ������>������<������=������
��2����֪ˮ��������ƽ�⣺H2O+H2O![]() H3O��+OH����H>0������ʹƽ�������ƶ�����������Һ�����ԣ�ѡ������з�����_______��
H3O��+OH����H>0������ʹƽ�������ƶ�����������Һ�����ԣ�ѡ������з�����_______��
A����ˮ�м���NaHSO4���� B����ˮ�м�NaHCO3����
C��������100�� [����c (H��) =1��10��6 mol��L-1] D����ˮ�м���NH4Cl����
��3�������£�pH=11��CH3COONa��Һ�У�ˮ���������c(OH��)=_______����pH=3��CH3COOH��Һ�У�ˮ���������c(H��)=_______��
��4��NH4Cl��Һ������Ũ�ȴ�С˳��Ϊ______________��
��5�����ʵ���Ũ����ͬ��������������������ϡ��Һ�У�NH4+Ũ���ɴ�С��˳���ǣ�����ţ�_______��
��6����֪t��ʱ��Kw=1��10-12���ڸ��¶�ʱ��pH=9��NaOH��Һa L��pH=2��H2SO4��ҺbL���(���Ի�Ϻ���Һ����ı仯���������û����Һ��pH=3,���a��b=_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С������֤CO2��Na2O2��Ӧ�IJ�����������ʵ��װ�ý���ʵ�飺

��1��д��װ��A�з�Ӧ�Ļ�ѧ����ʽ________��
��2��д��װ��B�з�Ӧ�Ļ�ѧ����ʽ________��
��3������װ��D�ռ��������뽫װ�ò�������________��
��4��������飺�����������ķ���________��
��5������������ķ�������Bװ����ȡ�������壬����ˮ�����Һ��________��
��6����ͬѧ��Ϊ��ʵ��װ�ô�������ȱ�ݣ�����Ϊ��ȱ����ʲô________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��ķ�Ӧԭ�������ӷ���ʽ��ʾ��ȷ���ǣ� ��
A. �����£�����Ȼ����ҺpH<7��֤��һˮ�ϰ��������NH4����2H2O=NH3��H2O��H3O��
B. ������������Һ��ȥþ���е���������2Al��2OH����2H2O=2AlO2����3H2��
C. ��̼��������Һ����ˮ�����е��Ȼ���
 +2HCO3-��
+2HCO3-�� +2H2O+2CO2��
+2H2O+2CO2��
D. �ø�����ر���Һ�ζ����2MnO4����16H����5C2O42��=2Mn2����10CO2����8H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ȼ�γɵ�����Ĥ�����䡣������Ϊ���Һ���ֱ���ʯī�������������������ϣ����������γ�������Ĥ����ʴ����ǿ�����Ʊ��ļ�Ҫ������ͼ��ʾ�������������������з�Ӧ�ķ���ʽ����ȷ����
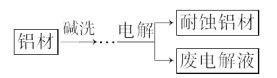
A. ��ϴĿ���dz�ȥ���ı������Ȼ����Ĥ��2OH����Al2O3===2AlO2-��H2O
B. ��ϴʱ���ı����������ݣ�2Al��2OH����2H2O===2AlO2-��3H2��
C. �����ʴ���ĵĵ缫��Ӧ��4Al��12e����3O2===2Al2O3
D. ��ϡ��ˮϴȥ��ʴ���ı�����NH3��H2O��H��===NH4+��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵���в���ȷ������ ��
A. ij�¶�ʱ�Ļ����Һ��c(H+)=![]() mol��L-1,˵������Һ������(KwΪ���¶�ʱˮ�����ӻ�����)
mol��L-1,˵������Һ������(KwΪ���¶�ʱˮ�����ӻ�����)
B. c(NH4+)Ũ����ȵ�������Һ��NH4Cl��NH4HSO4��(NH4)2SO4��(NH4)2CO3��(NH4)2Fe(SO4)2���ǵ����ʵ���Ũ���ɴ�С��˳��Ϊ��>��>��>�ۣ���
C. ��֪Ksp (AgCl)=1.56��10-10��Ksp (Ag2CrO4)=9.0��10-12,����Cl-��CrO42-��Ũ�Ⱦ�Ϊ0.010mol��L-1��Һ����μ���0.010mol��L-1��AgNO3��Һʱ��Cl-�Ȳ�������
D. 0.001mol��L-1AgNO3��Һ��0.001mol��L-1NaCl��Һ�������ϣ��ް�ɫ��������(���¶���AgCl��Ksp=1.56��10-10)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com