
ΓΨΧβΡΩΓΩΡ≥Εΰ¥ΈΒγ≥Ί≥δΓΔΖ≈ΒγΒΡΜ·―ßΖΫ≥Χ ΫΈΣ2K2S2+KI3![]() K2S4+3KIΘ§Τδ”κ≥δΒγΤδΥϊ…η±ΗΝ§Ϋ”ΒΡΒγ¬Ζ»γΆΦΥυ ΨΓΘΒ±±’ΚœΩΣΙΊK ±Θ§ΒγΦΪXΗΫΫϋ»ή“Κœ»±δΚλΓΘ‘ρœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
K2S4+3KIΘ§Τδ”κ≥δΒγΤδΥϊ…η±ΗΝ§Ϋ”ΒΡΒγ¬Ζ»γΆΦΥυ ΨΓΘΒ±±’ΚœΩΣΙΊK ±Θ§ΒγΦΪXΗΫΫϋ»ή“Κœ»±δΚλΓΘ‘ρœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. Ζ≈Βγ ±Θ§ΒγΦΪAΖΔ…ζΜΙ‘≠Ζ¥”Π
B. ΒγΦΪAΒΡΒγΦΪΖ¥”Π ΫΈΣ3I--2e-=I3-
C. Β±”–0.1mol K+Ά®Ιΐ―τάκΉ”ΫΜΜΜΡΛ ±Θ§ΒγΦΪX…œ≤ζ…ζΤχΧε1.12 L(±ξΉΦΉ¥Ωωœ¬)
D. Βγ≥Ί≥δΒγ ±Θ§ΒγΦΪB“Σ”κΆβΒγ‘¥ΒΡ’ΐΦΪœύΝ§Θ§ΒγΦΪ…œΖΔ…ζΜΙ‘≠Ζ¥”Π
ΓΨ¥πΑΗΓΩC
ΓΨΫβΈωΓΩ”…Χβ“βΫαΚœΆΦ Ψ–≈œΔΩ…ΒΟΘ§Β±±’ΚœΩΣΙΊK ±Θ§XΗΫΫϋ»ή“Κœ»±δΚλΘ§‘ρΥΒΟςXΗΫΫϋ”–OH-…ζ≥…Θ§Υυ“‘XΦΪ…œΖΔ…ζΒΟΒγΉ”ΒΡΜΙ‘≠Ζ¥”ΠΈω≥ω«βΤχΘ§XΦΪ «“θΦΪΘ§YΦΪ «―τΦΪΘ§”κ“θΦΪœύΝ§ΒΡ «‘≠Βγ≥ΊΒΡΗΚΦΪΘ§Υυ“‘ΒγΦΪA «ΗΚΦΪΘ§ΒγΦΪB «’ΐΦΪΓΘ
AœνΘ§Ζ≈Βγ ±AΈΣΗΚΦΪΘ§ΗΚΦΪ…œΖΔ…ζ ßΒγΉ”ΒΡ―θΜ·Ζ¥”ΠΘ§Ι A¥μΈσΘΜBœνΘ§ΒγΦΪAΈΣΗΚΦΪΘ§ΖΔ…ζ―θΜ·Ζ¥”ΠΘ§ΫαΚœΒγ≥ΊΉήΖ¥”ΠΘ§ΤδΒγΦΪΖ¥”Π ΫΈΣΘΚ2S22--2e-=S42-Θ§Ι B¥μΈσΘΜCœνΘ§Β±”–0.1molK+Ά®ΙΐάκΉ”ΫΜΜΜΡΛ ±Θ§Βγ¬Ζ÷–ΉΣ“Τ0.1molΒγΉ”Θ§ΗυΨί«βΤχ”κΒγΉ”ΒΡΙΊœΒ ΫH2~2e-Θ§Ω…ΦΤΥψ…ζ≥…«βΤχΒΡΧεΜΐΈΣ1.12L(±ξΉΦΉ¥Ωωœ¬)Θ§Ι C’ΐ»ΖΘΜDœνΘ§Βγ≥Ί≥δΒγ ±Θ§Τδ’ΐΦΪ(ΒγΦΪB)“Σ”κΆβΒγ‘¥ΒΡ’ΐΦΪœύΝ§Θ§Ής―τΦΪΘ§ΖΔ…ζ―θΜ·Ζ¥”ΠΘ§Ι D¥μΈσΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ…ηNAΈΣΑΔΖϋΦ”Β¬¬ό≥Θ ΐ÷ΒΘ§œ¬Ν–”–ΙΊ–π ω¥μΈσΒΡ «
A. 5.6g Fe»ή”ΎΙΐΝΩœθΥαΘ§ΒγΉ”ΉΣ“Τ ΐΡΩΈΣ0.3NA
B. ±ξΉΦΉ¥Ωωœ¬,11.2LΒΡSO3”κΉψΝΩΥ°≥δΖ÷Ζ¥”Π…ζ≥…ΒΡ»ή“Κ÷–H+ΒΡΉή ΐΈΣNA
C. ”…Na2O2ΚΆNa2OΉι≥…ΒΡΜλΚœΈοΙ≤l molΘ§Τδ÷–“θάκΉ” ΐΈΣNA
D. 3molNO2ΤχΧε»ή”ΎΉψΝΩΥ°÷–≥δΖ÷Ζ¥”ΠΉΣ“ΤΒΡΒγΉ”Ήή ΐΈΣ2NA
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ”Ο98%ΒΡ≈®ΝρΥαΘ®ΟήΕ»ΈΣ1.84gΓΛcm-3Θ©≈δ÷Τ80mLlmolΓΛL-1ΒΡœΓΝρΥαΓΘœ÷Ηχ≥ωœ¬Ν–“«ΤςΘ®≈δ÷ΤΙΐ≥Χ÷–Ω…Ρή”ΟΒΫΘ©ΘΚΔΌ25mLΝΩΆ≤ ΔΎl0mLΝΩΆ≤ Δέ50mL…’±≠ ΔήΆ–≈ΧΧλΤΫ Δί100mL»ίΝΩΤΩ ΔόΫΚΆΖΒΈΙή ΔΏ≤ΘΝßΑτΔύ80mL»ίΝΩΤΩ Θ§Α¥ Ι”Ο“«ΤςΒΡœ»ΚσΥ≥–ρ≈≈Ν–’ΐ»ΖΒΡ «
A. ΔΎΔόΔέΔΏΔίΔό B. ΔΌΔίΔΏΔό
C. ΔΌΔέΔύΔόΔΏ D. ΔήΔέΔΏΔύΔό
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Έ¬Ε»œ¬Θ§‘Ύ“ΜΗω2 LΒΡΟή±’»ίΤς÷–Θ§Φ”»κ4 mol AΚΆ2 mol BΫχ––Ζ¥”Π3A(g)+2B(g)![]() 4C(s)+2D(g)ΓΘΖ¥”Π“ΜΕΈ ±ΦδΚσ¥οΒΫΤΫΚβΘ§≤βΒΟ…ζ≥…1.6 molΘ§«“Ζ¥”Π«ΑΚσΒΡ―Ι«Ω÷°±»ΈΣ5ΘΚ4(œύΆ§ΒΡΈ¬Ε»œ¬≤βΝΩΘ©Θ§‘ρœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
4C(s)+2D(g)ΓΘΖ¥”Π“ΜΕΈ ±ΦδΚσ¥οΒΫΤΫΚβΘ§≤βΒΟ…ζ≥…1.6 molΘ§«“Ζ¥”Π«ΑΚσΒΡ―Ι«Ω÷°±»ΈΣ5ΘΚ4(œύΆ§ΒΡΈ¬Ε»œ¬≤βΝΩΘ©Θ§‘ρœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. ΗΟΖ¥”ΠΒΡΜ·―ßΤΫΚβ≥Θ ΐ±μ¥ο Ϋ «![]()
B. ¥Υ ±BΒΡΤΫΚβΉΣΜ·¬ «40%
C. ‘ω¥σΗΟΧεœΒΒΡ―Ι«ΩΘ§ΤΫΚβœρ”““ΤΕ·Θ§Μ·―ßΤΫΚβ≥Θ ΐ‘ω¥σ
D. ΤδΥϊΧθΦΰ≤Μ±δ ±Θ§‘ω¥σBΒΡ≈®Ε»Θ§BΒΡΤΫΚβΉΣΜ·¬ ≤Μ±δ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΑ―Υι÷ΫΤ§b≤Ι≥δΒΫa÷–Θ§Ω…ΒΟΒΫ“ΜΗωΆξ’ϊΒΡάκΉ”ΖΫ≥Χ ΫΘ®Έ¥≈δΤΫΘ©Θ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «

A. Ζ¥”ΠΈοΈΔΝΘ «SΓΔSO3-ΓΔOH-
B. ΗΟΖ¥”ΠΥΒΟςS2-ΚΆSO32-Ω…“‘‘ΎΦν–‘»ή“Κ÷–Ω…“‘¥σΝΩΙ≤¥φ
C. ―θΜ·ΦΝ”κΜΙ‘≠ΦΝΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ1:2
D. 3molS≤ΈΦ”Ζ¥”Π ±Θ§ΉΣ“ΤΒΡΒγΉ” ΐ3NA
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΥΒΖ®÷–≤Μ’ΐ»ΖΒΡ «( )
A. Κ§Ϋπ τ‘ΣΥΊΒΡάκΉ”≤Μ“ΜΕ® «―τάκΉ” B. Ϋπ τ‘≠Ή”÷Μ”–ΜΙ‘≠–‘
C. ‘ΣΥΊ”…Μ·ΚœΧ§±δΈΣ”ΈάκΧ§“ΜΕ®±Μ―θΜ· D. Ϋπ τ―τάκΉ”±ΜΜΙ‘≠≤Μ“ΜΕ®ΒΟΒΫΫπ τΒΞ÷
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
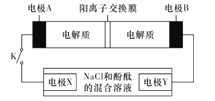
ΓΨΧβΡΩΓΩΖ«Ϋπ τΒΞ÷ AΨ≠»γΆΦΥυ ΨΒΡΙΐ≥ΧΉΣΜ·ΈΣΚ§―θΥαDΘ§“―÷ΣDΈΣ«ΩΥαΘ§«κΜΊ¥πœ¬Ν–Έ ΧβΓΘ
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Θ®1Θ©»τA‘Ύ≥ΘΈ¬œ¬ΈΣΙΧΧεΘ§B «Ρή ΙΤΖΚλ»ή“ΚΆ …ΪΒΡ”–¥ΧΦΛ–‘ΤχΈΕΒΡΈό…ΪΤχΧε:
ΔΌDΒΡΜ·―ß Ϋ «________ΘΜ
ΔΎ‘ΎΙΛ“Β…ζ≤ζ÷–Θ§BΤχΧεΒΡ¥σΝΩ≈≈Ζ≈±Μ”ξΥ°Έϋ ’Κσ–Έ≥…ΝΥ________ΕχΈέ»ΨΝΥΜΖΨ≥ΓΘ
Θ®2Θ©»τA‘Ύ≥ΘΈ¬œ¬ΈΣΤχΧεΘ§C «ΚλΉΊ…ΪΒΡΤχΧε:
ΔΌAΓΔCΒΡΜ·―ß ΫΖ÷±π «ΘΚA________ΘΜC________ΓΘ
ΔΎDΒΡ≈®»ή“Κ‘Ύ≥ΘΈ¬œ¬Ω…”κΆ≠Ζ¥”Π≤Δ…ζ≥…CΤχΧεΘ§«κ–¥≥ωΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ_______________________________________________ΓΘΗΟΖ¥”Π________(ΧνΓΑ τ”ΎΓ±ΜρΓΑ≤Μ τ”ΎΓ±)―θΜ·ΜΙ‘≠Ζ¥”ΠΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡή’ΐ»Ζ±μ Ψœ¬Ν–Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ
A. ΝρΜ·―«Χζ»ή”ΎœΓœθΥα÷–ΘΚFeS+2H+=Fe2++H2S![]()
B. NH4HCO3»ή”ΎΙΐΝΩΒΡNaOH»ή“Κ÷–ΘΚHCO3-+OH-=CO32-+H2O
C. …ΌΝΩSO2Ά®»κ±ΫΖ”ΡΤ»ή“Κ÷–ΘΚC6H5O-+SO2+H2O=C6H5OH+HSO3-
D. ¥σάμ ·»ή”Ύ¥ΉΥα÷–ΘΚCaCO3+2CH3COOH=Ca2++2CH3COO-+CO2![]() +H2O
+H2O
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΕΰΦΉΟ―(CH3OCH3)±Μ≥ΤΈΣ21 άΦΆΒΡ–¬–Ά»ΦΝœΘ§“‘COΚΆH2ΈΣ‘≠Νœ…ζ≤ζΕΰΦΉΟ―÷ς“ΣΖΔ…ζ“‘œ¬»ΐΗωΖ¥”ΠΘΚ
Μ·―ßΖ¥”ΠΖΫ≥Χ Ϋ | Μ·―ßΤΫΚβ≥Θ ΐ | |
ΔΌCO(g)ΘΪ2H2(g) | ΠΛH1=-99 kJmol-1 | K1 |
ΔΎ2CH3OH(g) | ΠΛH2ΘΫΘ≠24 kJmol-1 | K2 |
ΔέCO(g)ΘΪH2O(g) | ΠΛH3ΘΫΘ≠41 kJmol-1 | K3 |
Θ®1Θ©ΗΟΙΛ“’ΒΡΉήΖ¥”ΠΈΣ3CO(g)ΘΪ3H2(g)![]() CH3OCH3(g)ΘΪCO2(g) ΠΛH
CH3OCH3(g)ΘΪCO2(g) ΠΛH
ΗΟΖ¥”ΠΠΛHΘΫ__________________Θ§Μ·―ßΤΫΚβ≥Θ ΐKΘΫ____________________(”ΟΚ§K1ΓΔK2ΓΔK3ΒΡ¥ζ ΐ Ϋ±μ Ψ)ΓΘ
Θ®2Θ©Ρ≥Έ¬Ε»œ¬Θ§ΫΪ8.0molH2ΚΆ4.0molCO≥δ»κ»ίΜΐΈΣ2LΒΡΟή±’»ίΤς÷–Θ§ΖΔ…ζΖ¥”ΠΘΚ4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g)Θ§10 Ζ÷÷”ΚσΖ¥”Π¥οΤΫΚβΘ§≤βΒΟΕΰΦΉΟ―ΒΡΧεΜΐΖ÷ ΐΈΣ25%Θ§‘ρCOΒΡΉΣΜ·¬ ΈΣ________ΓΘ
CH3OCH3(g)+H2O(g)Θ§10 Ζ÷÷”ΚσΖ¥”Π¥οΤΫΚβΘ§≤βΒΟΕΰΦΉΟ―ΒΡΧεΜΐΖ÷ ΐΈΣ25%Θ§‘ρCOΒΡΉΣΜ·¬ ΈΣ________ΓΘ
Θ®3Θ©œ¬Ν–¥κ ©÷–Θ§ΡήΧαΗΏCH3OCH3≤ζ¬ ΒΡ”–________ΓΘ
AΘ°Ζ÷άκ≥ωΕΰΦΉΟ― BΘ°…ΐΗΏΈ¬Ε» CΘ°ΗΡ”ΟΗΏ–ߥΏΜ·ΦΝ DΘ°‘ω¥σ―Ι«Ω
Θ®4Θ©ΗΟΙΛ“’÷–Ζ¥”ΠΔέΒΡΖΔ…ζΧαΗΏΝΥCH3OCH3ΒΡ≤ζ¬ Θ§‘≠“ρ «_______________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com