
【题目】铝自然形成的氧化膜易脱落。以硫酸为电解液,分别以石墨和铝材作阴、阳极材料,经过电解处理形成氧化铝膜,抗蚀能力强。其制备的简要流程如图所示。下列用来解释流程中反应的方程式不正确的是
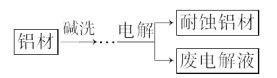
A. 碱洗目的是除去铝材表面的自然氧化膜:2OH-+Al2O3===2AlO2-+H2O
B. 碱洗时铝材表面会出现气泡:2Al+2OH-+2H2O===2AlO2-+3H2↑
C. 获得耐蚀铝材的电极反应:4Al-12e-+3O2===2Al2O3
D. 用稀氨水洗去耐蚀铝材表面的酸:NH3·H2O+H+===NH4++H2O
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84g·cm-3)配制80mLlmol·L-1的稀硫酸。现给出下列仪器(配制过程中可能用到):①25mL量筒 ②l0mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒⑧80mL容量瓶 ,按使用仪器的先后顺序排列正确的是
A. ②⑥③⑦⑤⑥ B. ①⑤⑦⑥
C. ①③⑧⑥⑦ D. ④③⑦⑧⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式为
A. 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S![]()
B. NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
C. 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO3-
D. 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
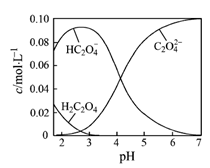
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)<2c(C2O42–)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、SO42-
B. c(H+)/c (OH-)=10-10的无色溶液:Na +、Ba2+、NO3-、Cl-
C. 由水电离产生c(H+)=10-10mol·L-1的溶液:![]() 、AlO2-、Ca2+、S2-
、AlO2-、Ca2+、S2-
D. c(ClO-)=1.0 mol·L-1的溶液:K+、SO32-、S2-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程(Fe3+在pH=5时已完全沉淀):
![]()
![]()
![]() ,②
,②![]()
![]()
![]()
![]()
![]() →CuSO4·5H2O晶体
→CuSO4·5H2O晶体
下列分析中正确的是
A. 用98%的浓硫酸配制溶解所用的4.5 mol·L-1的稀硫酸,只需3种玻璃仪器
B. 步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是向溶液Ⅰ中通入足量氯气
C. 利用Cu(OH)2替代CuO也可调节溶液pH而不影响实验结果
D. 步骤④之后的实验操作是蒸干溶剂结晶,所需仪器是蒸发皿、玻璃棒、酒精灯、泥三角、三脚架
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH
CH3OCH3(g)+CO2(g) ΔH
该反应ΔH=__________________,化学平衡常数K=____________________(用含K1、K2、K3的代数式表示)。
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件)
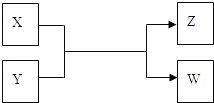
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是____________。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途_________________________。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到这种碘酸盐,此反应的离子方程式是______________________________________。
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是__________________________________。
(2)将3.48g Z加入50mL 4mol/L的稀HNO3中充分反应,产生112mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀.当沉淀量最多,至少需要加入2mol/L的NaOH溶液_____mL (精确到0.1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com