
【题目】X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件)
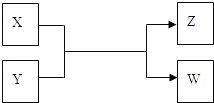
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是____________。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途_________________________。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到这种碘酸盐,此反应的离子方程式是______________________________________。
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是__________________________________。
(2)将3.48g Z加入50mL 4mol/L的稀HNO3中充分反应,产生112mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀.当沉淀量最多,至少需要加入2mol/L的NaOH溶液_____mL (精确到0.1)。
【答案】黄绿色 2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH3Cl2+I﹣+3H2O═6Cl﹣+IO3﹣+6H+3Fe+4H2O
H2↑+Cl2↑+2NaOH3Cl2+I﹣+3H2O═6Cl﹣+IO3﹣+6H+3Fe+4H2O![]() Fe3O4+4H297.5
Fe3O4+4H297.5
【解析】
(1)若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则W为I2,碘易升华,Z为NaCl,在氯碱工业中有重要的应用,X为氯气,Y为NaI,过量X与Y溶液反应时可以得到一种碘酸盐为碘酸钠;(2)X是工业上用量最大的金属单质,Y是一种具有磁性的黑色晶体,则X为Al,Y为Fe3O4,二者发生铝热反应。
Ⅰ.若W遇淀粉溶液变蓝,w是碘单质,X和Y反应生成碘和Z,Z是生活中常用的调味品,Z是氯化钠,根据元素守恒、氧化还原反应及X和W是单质、Y和Z为化合物知,X是氯气,Y是碘化钠;(1)通过以上分析知,X是氯气,为黄绿色气体;(2)工业上用电解饱和氯化钠溶液制取氢氧化钠,电解方程式为:2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH;(3)氯气有强氧化性,能把碘离子氧化生成碘酸根离子,同时自身被还原成氯离子,离子方程式为:3Cl2+I-+3H2O═6Cl-+IO3-+6H+;Ⅱ.若X是工业上用量最大的金属单质,则X是铁,Z是一种具有磁性的黑色晶体,Z是四氧化三铁,X、Y、Z、W四种物质有如下相互转化关系,其中X、W单质,Y、Z为化合物,该反应是铁和水蒸气反应生成氢气和四氧化三铁,所以W是氢气,Y是水.
H2↑+Cl2↑+2NaOH;(3)氯气有强氧化性,能把碘离子氧化生成碘酸根离子,同时自身被还原成氯离子,离子方程式为:3Cl2+I-+3H2O═6Cl-+IO3-+6H+;Ⅱ.若X是工业上用量最大的金属单质,则X是铁,Z是一种具有磁性的黑色晶体,Z是四氧化三铁,X、Y、Z、W四种物质有如下相互转化关系,其中X、W单质,Y、Z为化合物,该反应是铁和水蒸气反应生成氢气和四氧化三铁,所以W是氢气,Y是水.
(1)高温条件下,铁和水反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O![]() Fe3O4+4H2;(2)四氧化三铁和硝酸反应生成硝酸盐和NO,向溶液中滴加氢氧化钠溶液,硝酸盐和氢氧化钠反应生成沉淀和硝酸钠,根据溶液中硝酸根离子的量计算氢氧化钠的浓度,
Fe3O4+4H2;(2)四氧化三铁和硝酸反应生成硝酸盐和NO,向溶液中滴加氢氧化钠溶液,硝酸盐和氢氧化钠反应生成沉淀和硝酸钠,根据溶液中硝酸根离子的量计算氢氧化钠的浓度,
硝酸的物质的量=4mol/L×0.05L=0.2mol,充分反应,产生112mL的NO,根据氮原子守恒,硝酸和一氧化氮的物质的量之比为1:1,则溶液中剩余硝酸的物质的量=0.2mol-![]() =0.195mol,硝酸盐和氢氧化钠反应生成沉淀和硝酸钠,则氢氧化钠和硝酸根离子之间的物质的量之比为1:1,设氢氧化钠的体积为V,则
=0.195mol,硝酸盐和氢氧化钠反应生成沉淀和硝酸钠,则氢氧化钠和硝酸根离子之间的物质的量之比为1:1,设氢氧化钠的体积为V,则
NaOH------NO3-,
1mol 1mol
2V 0.195mol
V=97.5mL。


科目:高中化学 来源: 题型:
【题目】铝自然形成的氧化膜易脱落。以硫酸为电解液,分别以石墨和铝材作阴、阳极材料,经过电解处理形成氧化铝膜,抗蚀能力强。其制备的简要流程如图所示。下列用来解释流程中反应的方程式不正确的是
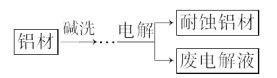
A. 碱洗目的是除去铝材表面的自然氧化膜:2OH-+Al2O3===2AlO2-+H2O
B. 碱洗时铝材表面会出现气泡:2Al+2OH-+2H2O===2AlO2-+3H2↑
C. 获得耐蚀铝材的电极反应:4Al-12e-+3O2===2Al2O3
D. 用稀氨水洗去耐蚀铝材表面的酸:NH3·H2O+H+===NH4++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中不正确的是( )
A. 某温度时的混合溶液中c(H+)=![]() mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
B. c(NH4+)浓度相等的下列溶液①NH4Cl②NH4HSO4③(NH4)2SO4④(NH4)2CO3⑤(NH4)2Fe(SO4)2它们的物质的量浓度由大到小的顺序为①>②>④>③>⑤
C. 已知Ksp (AgCl)=1.56×10-10.Ksp (Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,Cl-先产生沉淀
D. 0.001mol·L-1AgNO3溶液与0.001mol·L-1NaCl溶液等体积混合,无白色沉淀生成(该温度下AgCl的Ksp=1.56×10-10)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数。下列叙述中正确的是( )
A. 标准状况下,22.4 L SO3中含SO3分子数为NA
B. 46 g NO2中含有分子数为NA
C. 标况下22.4L Cl2与足量的NaOH溶液反应,转移的电子数为2NA
D. 标况下,足量的Fe与22.4L Cl2发生燃烧反应(Cl2完全反应),转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是( )
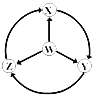 (选项中按 W X Y Z 的顺序)
(选项中按 W X Y Z 的顺序)
A. S SO2 SO3 H2SO4 B. Na Na2O2 NaOH NaCl
C. Fe FeCl3 Fe(OH)2 FeCl2 D. Al AlCl3 NaAlO2 Al2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液是中学化学及农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是____________。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
①图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。电解质溶液乙是_______(填“ZnSO4”或“CuSO4”)溶液;Cu极的电板反应式是_______。
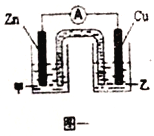
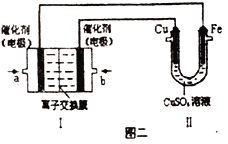
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则a处通入的是_______(填“CH4”或“O2”),a处电极上发生的电极反应式是_____________。若只把Ⅱ中电极均换为惰性电极,电解时的化学反应方程式为_____________________。若把Ⅱ中电极均换为惰性电极,电解液换为含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生的气体为672mL(标准状况下)时,溶液的pH=_______(假设电解后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①0.1mol/L硫酸②小苏打③纯碱④二氧化碳⑤葡萄糖⑥0.1mol/LNaOH溶液⑦SiO2 ⑧氨水⑨Al2O3⑩硫酸铁溶液
(1)上述十种物质中属于非电解质的有_____(填序号)。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,这两种物质的序号是______(填序号)。
(3)既能跟盐酸反应又能跟NaOH溶液反应的是_____(填序号)。
(4)标准状况下,_____L④中含有0.4mol氧原子。
(5)⑥与⑦溶液反应的离子方程式为__________。
(6)硅是信息技术的关键材料,写出工业上用⑦制备粗硅的化学反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.9 g镁铝合金投入到500 mL 2 mol/L的硫酸中,合金完全溶解,再加入4 mol/L的NaOH溶液,若要生成的沉淀最多,加入NaOH溶液的体积是
A. 125 mL B. 200 mL C. 250 mL D. 500 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A. Na2CO3+2HCl=2NaCl+H2O+CO2↑ B. 2 NaHCO3 ![]() Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2↑
C. Na2O+H2O=2NaOH D. Zn+H2SO4=ZnSO4 +H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com