
【题目】下列有关说法中不正确的是( )
A. 某温度时的混合溶液中c(H+)=![]() mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
B. c(NH4+)浓度相等的下列溶液①NH4Cl②NH4HSO4③(NH4)2SO4④(NH4)2CO3⑤(NH4)2Fe(SO4)2它们的物质的量浓度由大到小的顺序为①>②>④>③>⑤
C. 已知Ksp (AgCl)=1.56×10-10.Ksp (Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,Cl-先产生沉淀
D. 0.001mol·L-1AgNO3溶液与0.001mol·L-1NaCl溶液等体积混合,无白色沉淀生成(该温度下AgCl的Ksp=1.56×10-10)
【答案】D
【解析】A. ![]() ,某温度时的混合溶液中c(H+)=
,某温度时的混合溶液中c(H+)=![]() mol·L-1,说明该溶液中
mol·L-1,说明该溶液中![]() ,所以该溶液呈中性,A正确;B. c(NH4+)浓度相等的下列溶液①NH4Cl②NH4HSO4③(NH4)2SO4④(NH4)2CO3⑤(NH4)2Fe(SO4)2,①NH4Cl与②NH4HSO4相比,前者水解程度较大;③(NH4)2SO4④(NH4)2CO3⑤(NH4)2Fe(SO4)2相比,(NH4)2CO3双水解,水解程度最大,(NH4)2Fe(SO4)2溶液中,亚铁离子的水解抑制了铵根离子的水解,故其水解程度最小。所以,它们的物质的量浓度由大到小的顺序为①>②>④>③>⑤,B正确;C.向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,由Ksp(AgCl)=1.56×10-10、Ksp(Ag2CrO4)=9.0×10-12可以分别求出沉淀所需的c(Ag+)的最小值,分别为
,所以该溶液呈中性,A正确;B. c(NH4+)浓度相等的下列溶液①NH4Cl②NH4HSO4③(NH4)2SO4④(NH4)2CO3⑤(NH4)2Fe(SO4)2,①NH4Cl与②NH4HSO4相比,前者水解程度较大;③(NH4)2SO4④(NH4)2CO3⑤(NH4)2Fe(SO4)2相比,(NH4)2CO3双水解,水解程度最大,(NH4)2Fe(SO4)2溶液中,亚铁离子的水解抑制了铵根离子的水解,故其水解程度最小。所以,它们的物质的量浓度由大到小的顺序为①>②>④>③>⑤,B正确;C.向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,由Ksp(AgCl)=1.56×10-10、Ksp(Ag2CrO4)=9.0×10-12可以分别求出沉淀所需的c(Ag+)的最小值,分别为![]() ,所以Cl-先产生沉淀,C正确;D. 0.001mol·L-1AgNO3溶液与0.001mol·L-1NaCl溶液等体积混合,Qc=
,所以Cl-先产生沉淀,C正确;D. 0.001mol·L-1AgNO3溶液与0.001mol·L-1NaCl溶液等体积混合,Qc=![]() >Ksp(AgCl),所以溶液中有白色沉淀生成,D不正确。本题选D。
>Ksp(AgCl),所以溶液中有白色沉淀生成,D不正确。本题选D。


科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程(Fe3+在pH=5时已完全沉淀):
![]()
![]()
![]() ,②
,②![]()
![]()
![]()
![]()
![]() →CuSO4·5H2O晶体
→CuSO4·5H2O晶体
下列分析中正确的是
A. 用98%的浓硫酸配制溶解所用的4.5 mol·L-1的稀硫酸,只需3种玻璃仪器
B. 步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是向溶液Ⅰ中通入足量氯气
C. 利用Cu(OH)2替代CuO也可调节溶液pH而不影响实验结果
D. 步骤④之后的实验操作是蒸干溶剂结晶,所需仪器是蒸发皿、玻璃棒、酒精灯、泥三角、三脚架
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH
CH3OCH3(g)+CO2(g) ΔH
该反应ΔH=__________________,化学平衡常数K=____________________(用含K1、K2、K3的代数式表示)。
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 |
下列说法正确的是( )
A. 由实验数据可知实验控制的温度T2>T1
B. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
C. 40min时,表格中T2对应的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Na2CO3和NaHCO3的说法中,不正确的是
A. 焰色反应均为黄色
B. 溶解度:Na2CO3>NaHCO3
C. 可以用加热的方法除去Na2CO3固体中的NaHCO3杂质
D. 物质的量相同的两种固体分别与足量盐酸反应,Na2CO3产生的二氧化碳多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2 是一种高效安全的杀菌消毒剂。用氯化钠电解法生成ClO2的工艺原理示意图如下图, 发生器内电解生成ClO2。下列说法正确的是
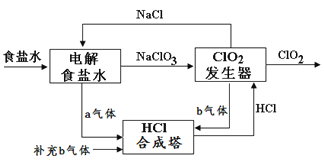
A. a气体是氯气,b气体是氢气
B. 氯化钠电解槽内每生成2 mol a气体,转移2mol e-
C. ClO2发生器中阴极的电极反应式为:2ClO3- + 12H+ + 10e-![]() Cl2↑ + 6H2O
Cl2↑ + 6H2O
D. 为使a、b气体恰好完全反应,理论上每生产1molClO2需要补充56L(标准状况)b气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件)
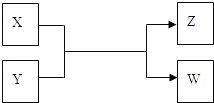
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是____________。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途_________________________。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到这种碘酸盐,此反应的离子方程式是______________________________________。
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是__________________________________。
(2)将3.48g Z加入50mL 4mol/L的稀HNO3中充分反应,产生112mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀.当沉淀量最多,至少需要加入2mol/L的NaOH溶液_____mL (精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:
①量取amL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用bmol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O32-=2I-+S4O62-。
试回答:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少________________________。
(2)滴定操作时,左手控制滴定管,右手__________,眼睛要注视__________。
(3)滴定(I2和S2O32-反应)以淀粉为指示剂,终点时溶液由__________色变为__________色。
(4)水中溶解氧的计算式是__________(以g/L为单位)。
(5)测定时,滴定管经蒸馏水洗涤后即加滴定剂Na2S2O3溶液,导致测定结果__________(填“偏高”“偏低”或“无影响”,下同)。
(6)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com