
【题目】下列关于Na2CO3和NaHCO3的说法中,不正确的是
A. 焰色反应均为黄色
B. 溶解度:Na2CO3>NaHCO3
C. 可以用加热的方法除去Na2CO3固体中的NaHCO3杂质
D. 物质的量相同的两种固体分别与足量盐酸反应,Na2CO3产生的二氧化碳多
【答案】D
【解析】
本题主要考查钠的重要化合物。A.钠元素焰色反应呈黄色;
B.正盐碳酸钠的溶解度大于酸式盐碳酸氢钠;
C.碳酸氢钠受热易分解生成碳酸钠;
D.根据碳守恒分析解答。
A.钠元素焰色反应呈黄色,所以两者焰色反应均为黄色,故A正确;
B.正盐碳酸钠的溶解度大于酸式盐碳酸氢钠,故B正确;
C.碳酸氢钠受热易分解生成碳酸钠,所以可以用加热的方法除去Na2CO3固体中的NaHCO3杂质,故C正确;
D.NaHCO3和Na2CO3都与足量盐酸反应生成二氧化碳气体:Na2CO3+2HCl=2NaCl+H2O+CO2![]() ,NaHCO3+HCl=NaCl+H2O+CO2
,NaHCO3+HCl=NaCl+H2O+CO2![]() ,等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,放出CO2体积相等,故D错误。
,等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,放出CO2体积相等,故D错误。


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
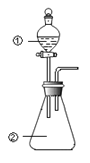
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
C | 氯化铁溶液 | 淀粉碘化钾溶液 | 溶液变为蓝色 |
D | 硫酸亚铁溶液 | 过氧化钠固体 | 产生气泡和白色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体各个系统特别是神经系统发育所不可缺少的微量元素。海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。某课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间,得到海带灰悬独液,然后按以下实验流程提取单质碘:

(1)灼烧海带时需要用到的实验仪器是___________(填标号)。
A.烧杯 B.蒸发皿 C.坩埚 D.三脚架 E.酒精灯 F.泥三角 G.玻璃棒
(2)图中操作①名称为______,操作③名称为__________。
(3)操作③中所用的有机试剂可以是_________(只填一种),理由是________。
(4)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.拧开漏斗下面的活塞,用烧杯接收下层溶液;
F.从分液漏斗上口倒出上层液体;
G.将分液漏斗上口的玻璃塞打开(或使塞上的凹槽与漏斗上口的小孔对准);
H.静置、分层。
过程③正确操作步骤的顺序是:________(填标号);上述G步操作的目的是:_______。
(5)检验提取碘后的水溶液中是否还含有单质碘的简单方法是_______
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还需要经过蒸馏。观察下图所示实验装置,指出需要改正的地方:_________。

上述蒸馏操作结束后,晶态碘在_________(填仪器名称)里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。
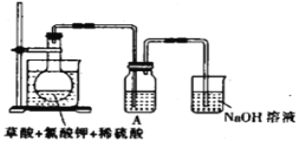
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为2KClO3+H2C2O4+2H2SO4![]() 2KHSO4+2ClO2↑+2CO2↑+2H2O。
2KHSO4+2ClO2↑+2CO2↑+2H2O。
①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是__________________,图示装置中缺少的一种必须的玻璃仪器是_______。
②装置A用于溶解产生的二氧化氯气体,其中最好盛放_________(填字母)。
A.20mL 60℃的温水 B.100mL冰水 C.100mL饱和食盐水 D.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为__________________
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
①步骤1中若要量取20.00mL水样,则应选用的仪器是_______________。
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:2ClO2+2KI=2KClO2+I2,2Na2S2O3+I2=Na2S4O6+2NaI,则步骤4中加入的指示剂为_____________,滴定达到终点时溶液的颜色变化为____________________。
③步骤5的目的是使I-将溶液中的ClO2-还原为Cl-以测定其含量,该反应的离子方程式为:_____________________________________________。
④若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原为Cl-,则该反应的氧化产物为_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中不正确的是
A. 丁达尔现象可用来区别胶体与溶液
B. 溶液、胶体、浊液的根本区别是分散质粒子直径的大小
C. 胶体在一定条件下会发生聚沉
D. 胶体粒子能通过半透膜,不能通过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法 | 现象 | 结论 | |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用;②砹(At)是第ⅦA族,其氢化物的稳定性大于HCl;③Na2FeO4可做水的消毒剂和净化剂;④陶瓷、玻璃、水晶、玛瑙、水泥、光导纤维的主要成分都是硅酸盐;⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应;⑥第三周期金属元素的最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱;⑦海水提镁的主要步骤为:

A. ①③④⑦ B. ①③⑥ C. ③④⑤⑦ D. ②④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)含有6.02×1023个H的H2O,其物质的量是_______;1 mol Na2SO4溶于水能电离出______个Na+。
(2)______mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(4)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为________。
(5)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CO32-、Cl-、OH-、SO42- |
已知:
①常温下A、C溶液pH均大于7,B溶液pH小于7,D溶液pH等于7;
②C溶液和D溶液混合只产生白色沉淀;
③B溶液和C溶液混合共热时只产生刺激性气味的气体;
④A溶液和D溶液混合时无明显现象。
请回答:
(1)D的化学式_______________________。
(2)实验③反应的离子方程式_______________________。
(3)从B、C、D中选取物质,设计实验方案确定A的组成_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com