
【题目】二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。
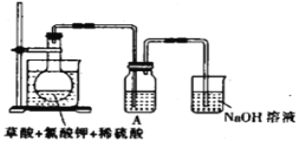
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为2KClO3+H2C2O4+2H2SO4![]() 2KHSO4+2ClO2↑+2CO2↑+2H2O。
2KHSO4+2ClO2↑+2CO2↑+2H2O。
①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是__________________,图示装置中缺少的一种必须的玻璃仪器是_______。
②装置A用于溶解产生的二氧化氯气体,其中最好盛放_________(填字母)。
A.20mL 60℃的温水 B.100mL冰水 C.100mL饱和食盐水 D.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为__________________
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
①步骤1中若要量取20.00mL水样,则应选用的仪器是_______________。
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:2ClO2+2KI=2KClO2+I2,2Na2S2O3+I2=Na2S4O6+2NaI,则步骤4中加入的指示剂为_____________,滴定达到终点时溶液的颜色变化为____________________。
③步骤5的目的是使I-将溶液中的ClO2-还原为Cl-以测定其含量,该反应的离子方程式为:_____________________________________________。
④若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原为Cl-,则该反应的氧化产物为_____(填化学式)。
【答案】使反应正常进行,并防止温度过高引起爆炸 温度计 B 6.75g 酸式滴定管 淀粉溶液 溶液蓝色褪去,且30秒内不恢复蓝色 ClO2-+4I-+4H+=Cl-+2I2+2H2O Fe(OH)3
【解析】
(1)①根据温度对二氧化氯的水溶液性质的影响分析解答;要控制温度需要温度计;
②常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,在较高温度下或水溶液中ClO2的质量分数高于30%易发生爆炸,据此解答;
③根据氯酸钾和草酸的质量关系判断反应的过量问题,计算生成二氧化氯的质量;
(2)①根据水样呈酸性判断需要的测量仪器;
②根据碘遇淀粉变蓝,分析解答;
③根据I-被氧化为I2,ClO2-还原为Cl-书写离子方程式;
④根据亚铁离子易被氧化为铁离子结合溶液的酸碱性分析判断。
(1)①由题目所给信息可知,温度过高,二氧化氯的水溶液有可能爆炸,所以控制温度的目的是:使反应正常进行,并防止温度过高引起爆炸;由于反应时温度保持在60~80℃之间,所以缺少的一种必须的玻璃仪器是温度计;
②装置A用于溶解产生的二氧化氯气体,为防止温度过高或水溶液中ClO2的质量分数高于30%而爆炸,应在100mL冰水中吸收,则B符合;
③n(KClO3)=12.25g÷122.5g/mol=0.1mol,n(H2C2O4)=9g÷90g/mol=0.1mol,根据方程式2KClO3+H2C2O4+2H2SO4![]() 2KHSO4+2ClO2↑+2CO2↑+2H2O可知H2C2O4过量,用KClO3的量计算,则生成的n(ClO2)=0.1mol,m(ClO2)=0.1mol×67.5g/mol=6.75g;
2KHSO4+2ClO2↑+2CO2↑+2H2O可知H2C2O4过量,用KClO3的量计算,则生成的n(ClO2)=0.1mol,m(ClO2)=0.1mol×67.5g/mol=6.75g;
(2)①根据题意水样pH为5.5~6.5,呈酸性,因此若要量取20.00mL水样,则应选用的仪器是酸式滴定管;
②根据题意可知滴定过程中出现了碘单质,碘遇淀粉变蓝,故选淀粉做指示剂。滴定到终点时,碘单质正好反应完,故滴定达到终点时溶液的颜色变化为溶液蓝色褪去,且30秒内不恢复蓝色;
③步骤5的目的是用I-将溶液中的ClO2-还原为Cl-以测定其含量,则I-被氧化为I2,故该反应的离子方程式为ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原为Cl-,亚铁离子被氧化为铁离子,由于溶液的酸性较弱,则铁离子转化为氢氧化铁,因此该反应的氧化产物为Fe(OH)3。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】某同学进行下列实验:
操作 | 现象 |
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水
| 放置一段时间后,生铁片上出现如图所示“斑痕”。边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈
|
下列对实验现象解释不正确的是
A. 中心区为蓝色的原因是铁失电子被氧化,Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀
B. 边缘处为红色的原因是发生吸氧腐蚀,生成了OH-,使溶液中c(OH-)>c(H+)
C. 边缘处为红色的原因是发生析氢腐蚀,消耗了H+,打破了水的电离平衡,使c(OH-)>c(H+)
D. 交界处出现铁锈的原因是4Fe2++8OH-+O2+2H2O=4Fe(OH)3,Fe(OH)3分解得到铁锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。
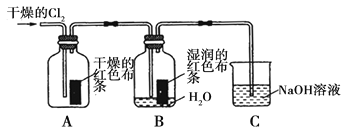
①通入Cl2 后,观察到的现象是 根据现象可得出的结论是 。
②集气瓶B发生反应的离子方程式是 。
③C装置的作用是 ,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为 _mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
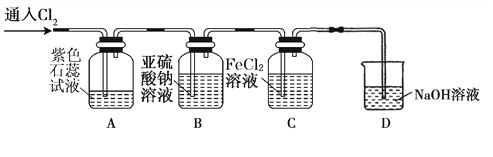
①实验开始后,观察装置A 中的现象是 。
②装置C中发生反应的离子方程式是 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生 反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在一定量0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列说法不正确的是( )

A. a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
B. Ksp[Al(OH3)]=10-32
C. c~d段,溶液中离子浓度的关系为:c(Na+)+ c(H+)+ 3c(Al3+)= c(OH-)+c(AlO2-)
D. d点时,溶液中离子浓度的大小关系为:c(Na+)>c(AlO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化的须色变化。实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。完成下列问题:
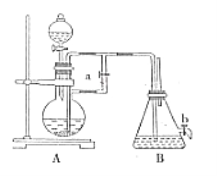
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是_______________,A中发生反应的目的是_____________________________。
(2)实验开始时应先将弹簧夹a________(填“打开”或“关闭”)。
(3)装置B中生成Fe(OH)2的操作及观察到的现象为_______________。
(4)实验完毕,打开b处弹簧夹,放入一部分空气,此时B中发生的反应为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:
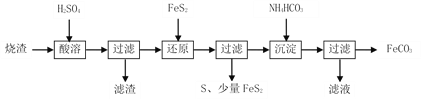
(1)“酸溶”时加快反应速率的方法有___________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___________;
②FeS2还原后,检验Fe3+是否反应完全的方法是___________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_________________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g。则Fe2O3的质量为______ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Na2CO3和NaHCO3的说法中,不正确的是
A. 焰色反应均为黄色
B. 溶解度:Na2CO3>NaHCO3
C. 可以用加热的方法除去Na2CO3固体中的NaHCO3杂质
D. 物质的量相同的两种固体分别与足量盐酸反应,Na2CO3产生的二氧化碳多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,Ksp(AgNO2)=2×10-8 mol2·L-2;Ksp(AgCl)=1.8×10-10 mol2·L-2。
(1)向2 mL 0.1 mol·L-1 NaNO2 溶液中滴加几滴稀硝酸银溶液,出现白色沉淀,再滴入0.5 mol·L-1 NaCl溶液,发生反应:AgNO2(s)+Cl-(aq)![]() AgCl(s)+NO2-(aq),则该反应的化学平衡常数K= 。
AgCl(s)+NO2-(aq),则该反应的化学平衡常数K= 。
(2)取物质的量浓度均为 0.1 mol·L-1 NaNO2、NaCl的混合溶液,逐滴加入AgNO3溶液(忽略体积改变)。当 AgNO2开始沉淀时,计算溶液中Cl-的物质的量浓度(写出必要的计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素基态原子的价层电子排布式为_____________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Y的曲线是_________(填标号)。
[Failed to download image : http://192.168.0.10:8086/QBM/2018/6/1/1957930255540224/1961602752167936/STEM/676db9e64b15468faa67ccb9aa300976.png]
(3)化合物(XH2=X=O)分子中X原子杂化轨道类型分别是_____________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为________________。
(5)某R的氧化物立方晶胞结构如图所示,该物质的化学式为____________。(用元素符号表示),已知该晶体密度为ρg/cm3,距离最近的原子间距离为dpm,则R的相对原子质量为____________。(阿伏加德罗常数为NA)
[Failed to download image : http://192.168.0.10:8086/QBM/2018/6/1/1957930255540224/1961602752167936/STEM/02395761f35f4972ad3c8807ad342892.png]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com