
����Ŀ������˵������ȷ����
�ٸ������濾������һ�����ܵ�Fe3O4��������ʴ����������(At)�ǵ���A�壬���⻯����ȶ��Դ���HCl����Na2FeO4����ˮ���������;����������մɡ�������ˮ������觡�ˮ�ࡢ���ά����Ҫ�ɷֶ��ǹ�����������(Tl)����ͬ���壬�䵥�ʼ��������ᷴӦ������������������Һ��Ӧ���������ڽ���Ԫ�ص�����������Ӧ��ˮ����������ԭ��������������������ߺ�ˮ��þ����Ҫ����Ϊ��

A. �٢ۢܢ� B. �٢ۢ� C. �ۢܢݢ� D. �ڢܢ�
���𰸡�B
��������
�����ܵ��������ܱ�������Ľ�������Ԫ�صķǽ�����Խǿ����̬�⻯����ȶ���Խǿ����Na2FeO4����Ϊ+6�ۣ��ܲ�����ˮ�����ڹ����β�Ʒ��ˮ����ʯӢ����觵���Ҫ�ɷֶ���SiO2���ݸ���Ԫ�����ڱ���ͬ����Ԫ�����ʵı仯����������������Ԫ�����ڱ���ͬ����Ԫ�����ʵı仯�������ȽϽ����ԣ�������Խǿ��������������Ӧˮ����ļ���Խǿ���߹�ҵ���ǵ�����ڵ��Ȼ�þ����þ��
�����������������ܵ��ܱ����ڲ��ĸ���������ʴ���ʢ���ȷ��
�ڵ�VIIA��ClԪ�صķǽ����Դ������ķǽ����ԣ��������⻯����ȶ���С��HCl���ʢڴ���
��Na2FeO4����Ϊ+6�ۣ�����ǿ�����ԣ���ɱ������������ԭ������Fe3+����ˮ��Ϊ�������������ܾ�ˮ���ʢ���ȷ��
�ܲ�����ˮ�����ڹ����β�Ʒ��ˮ����ʯӢ����觵���Ҫ�ɷֶ���SiO2���ʢܴ���
���裨Tl������ͬ���壬��ԭ������������������ǿ���������Tl��Al����Tl�����ᷴӦ������������������Һ��Ӧ���ʢݴ���
�������ڽ���Ԫ����ԭ����������������Լ�����������Na��Mg��Al�������Ԫ�ص�����������Ӧˮ����������ԭ��������������������ʢ���ȷ��
�ߵ���Ȼ�þ��Һ�ò���Mg����ҵ���ǵ�����ڵ��Ȼ�þ����þ���ʢߴ���
�ʢ٢ۢ���ȷ����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪298Kʱ��Ksp(NiS)��1.0��10-21��Ksp(NiCO3)��1.0��10-7 ��p(Ni)����lg c(Ni2+)��p(B)����lg c(S2-)����lg c(CO32-)���ں����ʵ���Ũ����ͬ��Na2S��Na2CO3�Ļ����Һ�еμ�Ni(NO3)2��Һ�������ֳ�������Һ�������ӡ�������Ũ�ȹ�ϵ��ͼ��ʾ������˵���������

A. ������NiCO3���ܽ�ȴ���NiS���ܽ��
B. ��d���Ӧ����Һ�м����Ӧ�����ӵ����Σ�d����b���ƶ�
C. ��������I����b����ȣ�b����c���ƶ�
D. PΪ3.5�Ҷ�Ӧ����������CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ�ÿ�������ȡ�۲�Fe(OH)2�ڿ����б���������ɫ�仯��ʵ��ʱ����ʹ����м��6mol/L�����ᣬ�����Լ���ѡ������������⣺
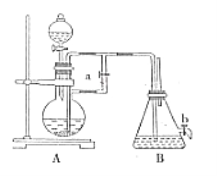
��1��B��ʢ��һ������NaOH��Һ��A��ӦԤ�ȼ�����Լ���_______________��A�з�����Ӧ��Ŀ����_____________________________��
��2��ʵ�鿪ʼʱӦ�Ƚ����ɼ�a________(�������������ر���)��
��3��װ��B������Fe(OH)2�IJ������۲쵽������Ϊ_______________��
��4��ʵ����ϣ���b�����ɼУ�����һ���ֿ�������ʱB�з����ķ�ӦΪ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Na2CO3��NaHCO3��˵���У�����ȷ����
A. ��ɫ��Ӧ��Ϊ��ɫ
B. �ܽ�ȣ�Na2CO3>NaHCO3
C. �����ü��ȵķ�����ȥNa2CO3�����е�NaHCO3����
D. ���ʵ�����ͬ�����ֹ���ֱ����������ᷴӦ��Na2CO3�����Ķ�����̼��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al(SO4)2��NH4HSO4��;�㷺����ش��������⣺
��1������ʱ��0.1 mol��L-1 NH4Al(SO4)2��Һ��pH=3������Һ��c(NH4��)+c(NH3��H2O)_______c (Al3+) + c��Al(OH)3�ݣ����������������=������2c(SO42��)- c(NH4��)-3c(Al3+)=________mol��L-1������ֵ����
��2��80��ʱ��0.1 mol��L-1 NH4Al(SO4)2��Һ��pHС��3����������pH���¶ȱ仯��ԭ����________________________ �������ӷ���ʽ��������������ش𣩡�
��3������ʱ����100 mL 0.1 mol��L-1 NH4HSO4��Һ�еμ� 0.1 mol��L-1 NaOH��Һ���õ���ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ��ʾ����NH4HSO4��Һ�еμ�NaOH��Һ��a��Ĺ����У�������Ӧ�����ӷ���ʽΪ__________________��
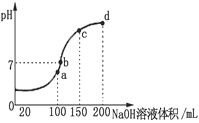
��4��Ũ�Ⱦ�Ϊ0.1 mol��L-1 NH4Al(SO4)2��Һ��NH4HSO4��Һ������______��Һc(NH4��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������£�Ksp(AgNO2)��2��10-8 mol2��L-2��Ksp(AgCl)��1.8��10-10 mol2��L-2��
��1����2 mL 0.1 mol��L-1 NaNO2 ��Һ�еμӼ���ϡ��������Һ�����ְ�ɫ�������ٵ���0.5 mol��L-1 NaCl��Һ��������Ӧ��AgNO2(s)+Cl-(aq)![]() AgCl(s)+NO2-(aq)����÷�Ӧ�Ļ�ѧƽ�ⳣ��K�� ��
AgCl(s)+NO2-(aq)����÷�Ӧ�Ļ�ѧƽ�ⳣ��K�� ��
��2��ȡ���ʵ���Ũ�Ⱦ�Ϊ 0.1 mol��L-1 NaNO2��NaCl�Ļ����Һ����μ���AgNO3��Һ����������ı䣩���� AgNO2��ʼ����ʱ��������Һ��Cl-�����ʵ���Ũ�ȣ�д����Ҫ�ļ�����̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3Cl2��6KOH![]() KClO3��5KCl��3H2O�ķ�Ӧ��������˵������ȷ���� (����)
KClO3��5KCl��3H2O�ķ�Ӧ��������˵������ȷ���� (����)
A. Cl2����������KOH�ǻ�ԭ��
B. KCl�ǻ�ԭ���KClO3����������
C. ��Ӧ��ÿ����3 mol Cl2��ת�Ƶ�����Ϊ5NA
D. ����ԭ�����������ʵ����DZ����������������ʵ�����5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ�ؿ���ʹ���ں���ɻ��ϣ��䷴Ӧԭ����ͼ��ʾ�������й�����ȼ�ϵ�ص�˵��������ȷ����
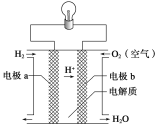
A. �õ���е缫a������
B. ���·�е����ɵ缫bͨ����������缫a
C. �õ�ص�������ӦΪO2��4H����4e�� �� 2H2O
D. �õ�ص��ܷ�Ӧ��2H2��O2 �� 2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:N2(g)+3H2(g)![]() 2NH3(g)��H=-92.4kJ/mol��ʼ��Ӧ��ΪN2��H2���ʵ���֮��Ϊ1:3,�������ʵ������䣬�ڲ�ͬѹǿ�͞E���£���Ӧ�ﵽƽ��ʱ��ϵ��NH3�����ʵ����������±�:
2NH3(g)��H=-92.4kJ/mol��ʼ��Ӧ��ΪN2��H2���ʵ���֮��Ϊ1:3,�������ʵ������䣬�ڲ�ͬѹǿ�͞E���£���Ӧ�ﵽƽ��ʱ��ϵ��NH3�����ʵ����������±�:
�¶� ���ʵ������� ѹǿ | 400�� | 450�� | 500�� | 600�� |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
����˵����ȷ����
A. ��ϵ��NH3�����ʵ�������Խ��������Ӧ����Խ��
B. ��Ӧ�ﵽƽ��ʱ��N2��H2��ת����֮�Ⱦ�Ϊ1
C. ��Ӧ�ﵽƽ��ʱ���ų���������Ϊ92.4kJ
D. 600��,30MPa�·�Ӧ�ﵽƽ��ʱ������NH3�����ʵ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com