
【题目】现有下列十种物质:①0.1mol/L硫酸②小苏打③纯碱④二氧化碳⑤葡萄糖⑥0.1mol/LNaOH溶液⑦SiO2 ⑧氨水⑨Al2O3⑩硫酸铁溶液
(1)上述十种物质中属于非电解质的有_____(填序号)。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,这两种物质的序号是______(填序号)。
(3)既能跟盐酸反应又能跟NaOH溶液反应的是_____(填序号)。
(4)标准状况下,_____L④中含有0.4mol氧原子。
(5)⑥与⑦溶液反应的离子方程式为__________。
(6)硅是信息技术的关键材料,写出工业上用⑦制备粗硅的化学反应方程式_________。
【答案】④⑤⑦ ①⑥ ②⑨ 4.48 SiO2+2OH-= SiO32-+H2O SiO2+2C![]() Si+2CO↑
Si+2CO↑
【解析】
(1)根据非电解质的定义,属于非电解质是④⑤⑦;
(2)根据离子反应方程式,酸应是强酸,碱是可溶的强碱,符合题意的是0.1mol·L-1硫酸和0.1mol·L-1NaOH发生反应,即①⑥符合;
(3)既能与盐酸反应又能与NaOH溶液反应的物质两性氧化物、两性氢氧化物、弱酸的酸式盐、弱酸的铵盐等物质,即符合题意的是NaHCO3(小苏打)和Al2O3,故选项②⑨符合题意;
(4)1molCO2中含有2mol氧原子,即含有0.4mol氧原子的CO2物质的量为0.2mol,标准状况下CO2的体积为0.2mol×22.4L·mol-1=4.48L;
(5)SiO2属于酸性氧化物,不能拆写成离子形式,即⑥和⑦反应的离子方程式为SiO2+2OH-=SiO32-+H2O;
(6)用SiO2制备粗硅,工业上常用C与SiO2反应,其化学反应方程式为SiO2+2C![]() Si+2CO↑。
Si+2CO↑。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程(Fe3+在pH=5时已完全沉淀):
![]()
![]()
![]() ,②
,②![]()
![]()
![]()
![]()
![]() →CuSO4·5H2O晶体
→CuSO4·5H2O晶体
下列分析中正确的是
A. 用98%的浓硫酸配制溶解所用的4.5 mol·L-1的稀硫酸,只需3种玻璃仪器
B. 步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是向溶液Ⅰ中通入足量氯气
C. 利用Cu(OH)2替代CuO也可调节溶液pH而不影响实验结果
D. 步骤④之后的实验操作是蒸干溶剂结晶,所需仪器是蒸发皿、玻璃棒、酒精灯、泥三角、三脚架
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2 是一种高效安全的杀菌消毒剂。用氯化钠电解法生成ClO2的工艺原理示意图如下图, 发生器内电解生成ClO2。下列说法正确的是
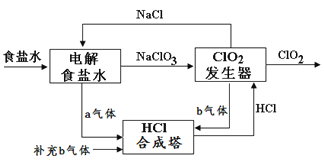
A. a气体是氯气,b气体是氢气
B. 氯化钠电解槽内每生成2 mol a气体,转移2mol e-
C. ClO2发生器中阴极的电极反应式为:2ClO3- + 12H+ + 10e-![]() Cl2↑ + 6H2O
Cl2↑ + 6H2O
D. 为使a、b气体恰好完全反应,理论上每生产1molClO2需要补充56L(标准状况)b气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件)
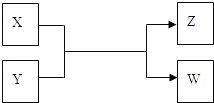
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是____________。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途_________________________。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到这种碘酸盐,此反应的离子方程式是______________________________________。
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是__________________________________。
(2)将3.48g Z加入50mL 4mol/L的稀HNO3中充分反应,产生112mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀.当沉淀量最多,至少需要加入2mol/L的NaOH溶液_____mL (精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。
(1)实验室制备原料气NO和Cl2的装置如下图所示:

①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为_______。
②实验室制Cl2时,装置B中盛放的试剂为________,其作用是________。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。
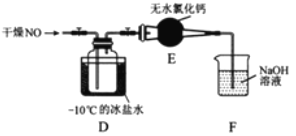
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为________。
②装置D中的现象为________。
③装置E中无水氯化钙的作用为________。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是________。
(3)NO可用间接电化学法除去,其原理如下图所示:

①阴极的电极反应式为______________________。
②吸收塔内发生反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是
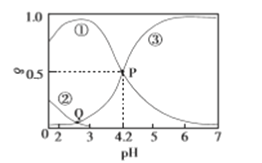
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. Q点对应的溶液中lgc(H+)<lgc(OH-)
C. 20℃时,H2C2O4的一级电离平衡常数Ka1=1×10-4.2
D. 0.100mol/L的NaHC2O4溶液中:c(OH-)=c(H+)- c(C2O42-)+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,3.36L某气态烃A在足量O2中完全燃烧。若将产物通入足量澄清石灰水中,得到的白色沉淀质量30.0g;若用足量的碱石灰吸收燃烧产物,增重18.6g。则该烃的分子式为( )
A. C2H6 B. C3H8 C. C3H6 D. C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:
①量取amL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用bmol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O32-=2I-+S4O62-。
试回答:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少________________________。
(2)滴定操作时,左手控制滴定管,右手__________,眼睛要注视__________。
(3)滴定(I2和S2O32-反应)以淀粉为指示剂,终点时溶液由__________色变为__________色。
(4)水中溶解氧的计算式是__________(以g/L为单位)。
(5)测定时,滴定管经蒸馏水洗涤后即加滴定剂Na2S2O3溶液,导致测定结果__________(填“偏高”“偏低”或“无影响”,下同)。
(6)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下一定体积的HCl气体,将其溶于500mL的稀硫酸溶液中,假设溶液的体积不变化,向混合溶液中加入0.60mol/L的NaOH溶液50mL恰好呈中性。继续向呈中性的溶液中加入过量的氯化钡溶液,所的沉淀的质量为2.33g。
(1)生成沉淀的离子反应方程式:_______________________________。
(2)原硫酸溶液的浓度为:______________________________________。
(3)标准状况下HCl气体的体积为多少毫升?(写出计算过程)__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com