
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是
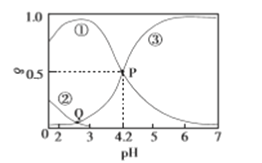
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. Q点对应的溶液中lgc(H+)<lgc(OH-)
C. 20℃时,H2C2O4的一级电离平衡常数Ka1=1×10-4.2
D. 0.100mol/L的NaHC2O4溶液中:c(OH-)=c(H+)- c(C2O42-)+c(H2C2O4)
科目:高中化学 来源: 题型:
【题目】下列实验操作、实验现象和实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 将乙烯分别通入溴水和酸性高锰酸钾溶液 | 溶液均褪色 | 二者反应类型相同 |
B | 对于密闭烧瓶中的已达到平衡的可逆反应:2NO2 | 混合气体颜色变深 | 加热该化学平衡可向正向移动 |
C | 某溶液中加入新制氢氧化铜悬浊液,加热 | 有砖红色沉淀生成 | 该溶液一定是葡萄糖溶液 |
D | 甲烷和氯气混合气体充入大试管中,倒立在水槽里,置于光亮处,过一段时间后,将试管从水槽中取出,向其中滴入几滴石蕊溶液 | 溶液变红 | 甲烷和氯气反应产物中有氯化氢 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)已知:①CO(g)+ ![]() O2(g)=CO2(g)△H=-283.0kJmol-1
O2(g)=CO2(g)△H=-283.0kJmol-1
②CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=-726.5kJmol-1
O2(g)=CO2(g)+2H2O(l)△H=-726.5kJmol-1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为2molN2时的△H= 。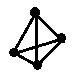
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】21世纪是纳米科技崭露头角的时代。下列分散系的分散质粒子直径在1nm~100nm之间的是
A.盐酸B.蔗糖溶液C.油水混合物D.Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土有工业“黄金”之称,我国稀土资源丰富。目前从氟碳铈矿(主要化学成分为CeFCO3)提取铈族稀土元素的冶炼处理工艺已经发展到十几种,其中一种提取铈的工艺流程如下:

已知:①焙烧后烧渣中含+4价的铈及+3价的其它稀土氟氧化物:
②Ce4+能与SO42-结合成CeSO4,Ce4+能被萃取剂[(HA)2]萃取。
请回答下列问题:
(1)CeFCO3中,Ce元素的化合价为_____。
(2)“酸浸I”过程中CeO2转化为Ce3+,且产生黄绿色气体,用稀硫酸和H2O2,替换HCl就不会造成环境污染。则稀硫酸.H2O2与CeO2反应的离子方程式为:__________。
(3)“沉淀”步骤中发生的反应为:Ce(BF4)3(s)+3KCl(aq)=3KBF4(s)+CeCl3(aq)。已知Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数为______(用含a、b的代数式表示)。
(4)“浸出液”中含有少量Ce4+及其他稀土元素的离子,可以通过“萃取”与“反萃取寻探作进一步分离、富集各离子。“萃取”时Ce4+与萃取剂[(HA)2]存在的反应为:Ce4++n(HA)2![]() Ce(H2a-4A2a)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2a-4A2a)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-),D随浸出液中c(SO42-)增大而减小的原因是__________。
)其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-),D随浸出液中c(SO42-)增大而减小的原因是__________。
(5)“操作I”后,向溶液中加入NaOH溶液,调节溶液的pH可获得Ce(OH)3沉淀,当溶液中离子浓度小于1.0×10-6mol/L视为沉淀完全,常温下加入NaOH调节溶液的pH应大于_______[已知:Ce(OH)3的Ksp=8.0×10-21;1g2=-0.3]
(6)写出“氧化”步骤的化学方程式:_______________。
(7)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧在尾气消除过程中发生着CeO2![]() CeO2(1-x) +xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:________________。
CeO2(1-x) +xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质分类和胶体的叙述.下列有关物质的分类说法正确的是
A.金属氧化物一定是碱性氧化物
B.胶体和其他分散系的本质区别是分散质粒子大小不同
C.生石灰、醋酸、纯碱、氯化钠对应的物质类别是氧化物、酸、碱、盐
D.酸性氧化物一定是非金属氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量.下列表示氢氧化钠加入量(x)与溶液中沉淀的量(y)的关系示意图中正确的是( )
A.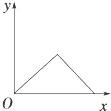
B.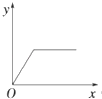
C.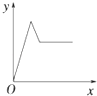
D.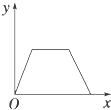
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵品体[(NH4)2Fe(SO4)2·6H2O]又称摩尔盐,是一种重要的化工原料,用途十分广泛。
(1)基态Fe2+的核外电子排布式为_____________________。
(2)氨是合成摩尔盐的重要原料,工业合成氨中,原料气在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收其中的杂质CO气体,其反应方程式为:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)](Ac-=CH3COO-)
[Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)](Ac-=CH3COO-)
①醋酸中碳原子的杂化方式是_________,1mol乙酸分子中含有σ键的数目为_________________。
②C、N、O三种元素的第一电离能由小到大的顺序为___________________________。
③与CO互为等电子体的分子为___________(填化学式),NH3的空间构型为__________________。
(3)N和P都是第VA族元素,其最简单氢化物熔点的大小关系为_________,主要原因是__________________________________。
(4)铁在不同温度范围有不同的晶体结构。室温下铁是简单立方,称为α铁(α-Fe)。当温度升高到912℃,α铁转变为面心立方,称为γ铁(γ-Fe)。当温度继续升高到1394 ℃,γ铁转变为体心立方。称为δ铁(δ-Fe)。

①γ铁晶体中铁原子配位数是____________________。
②δ铁晶体密度为dg·cm-3,则其晶胞参数(边长)为__________cm(阿伏加德罗常数用NA表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com