
【题目】21世纪是纳米科技崭露头角的时代。下列分散系的分散质粒子直径在1nm~100nm之间的是
A.盐酸B.蔗糖溶液C.油水混合物D.Fe(OH)3胶体
 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 | Ka1=5.9×10-2 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为。
(4)若0.1mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=mol·L-1(填精确计算结果)。
(5)将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列符号代表一些能层或能级的能量,请将它们按能量由低到高的顺序排列。
(1)EK、EN、EL、EM:______________。
(2)E3s、E2s、E4s、E1s:____________。
(3)E4s、E4d、E4p、E4f:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干
B.用10mL量筒量取8.58mL蒸馏水
C.容量瓶定容时观察液面时俯视,会使配得的溶液浓度偏大
D.用酒精萃取碘水中的I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应的叙述不正确的是
A.有元素化合价发生变化的反应一定是氧化还原反应
B.分解反应的反应物只有一种
C.化合反应的生成物只有一种
D.有单质生成的反应一定是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是
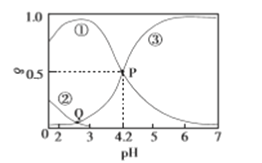
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. Q点对应的溶液中lgc(H+)<lgc(OH-)
C. 20℃时,H2C2O4的一级电离平衡常数Ka1=1×10-4.2
D. 0.100mol/L的NaHC2O4溶液中:c(OH-)=c(H+)- c(C2O42-)+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷、甲醇都是清洁能源。
(1)已知下列热化学方程式
①CO2(g)+3H2(g)=CH3OH(g) +H2O (g)△H= -49.0 kJ/mol
②CH4(g)+2O2(g)=2H2O(g) +CO2(g) △H= -802.3 kJ/mol
③2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
④H2O(g)=H2O(l) △H= -44.0 kJ-mol
则CH4(g)+1/2O2(g)=CH3OH(g) △H =____________。
(2)工业上合成甲醇的另一种方法是2H2(g)+CO(g) ![]() CH3OH(g) △H。
CH3OH(g) △H。
一定温度下在3个体积均为1.0 L的恒容密闭容器中发生上述反应,相关物理量见下表:
容器 | 温度/K | 物质的起始浓度/molL-1 | 物质的平衡浓度/mol.L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
①该反应的△H______0(填“>”或“<”)。
②达到平衡时,容器I中c(CH3OH)_____0.16mol/L(填“>” “<” 或“=”)。
③400 K 时该反应的平衡常数K=________。
(3)文献报道某课题组利用CO2催化缺化制甲烷的研究过程如下:
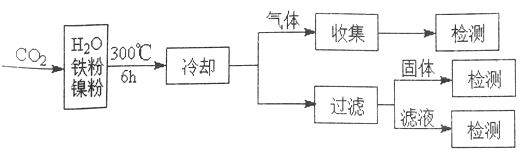
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2 的产量和镍粉用量的关系如下图所示(仪改变镍粉用量,其他条件不变)。研究人员根据实验结果得出结论:HCOOH 是CO2转化为CH4 的中间体,即:![]()
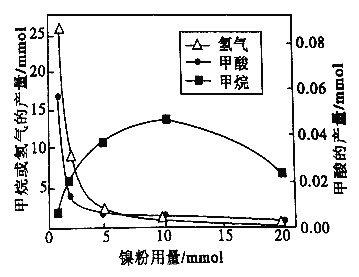
①写出产生H2的反应方程式_________。
②由图可知,镍粉是_______(填字母)。
a.反应I的催化剂 b.反应II 的催化剂
c.反应I和II的催化剂 d.不是催化剂
③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是______(填字母)。
a.反应1的速率增加,反应II的速率不变
b.反应I的速率不变,反应II的速率增加
c.反应I、II的速率均不变
d.反应I、II的速率均增加,且反应I的速率增加得快
e.反应I、II的速率均增加,且反应II 的速率增加得快
f.反应I的速率减小,反应II的速率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂酸性废液中含有Fe3+、Al3+、Fe2+、SO42-,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略):
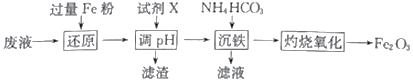
已知:①NH4HCO3在热水中会分解。
②常温下,溶液中不同金属离子生成氢氧化物沉淀时的pH见下表:
金属离子(0.1mol·L-l) | Fe3+ | Fe2+ | Al3+ |
开始沉淀时的pH | 2.4 | 7.6 | 3.4 |
完全沉淀时的pH | 3.7 | 9.6 | 4.8 |
回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:_________________________________。
(2)试剂X可选用_________(任写一种,填化学式),“滤渣”的主要成分是_________________。
(3)加入碳酸氢铵后过滤,发现滤液仍然浑浊,可能的原因是_________________________,用90℃热水洗涤FeCO3沉淀的目的是______________________________________。
(4)若在实验室中灼烧FeCO3应在_____________(填仪器名称)中进行,“灼烧氧化”发生的化学方程式为__________________________________。
(5)若工业上灼烧氧化174.0吨FeCO3得到117.6吨产品,则该产品中Fe2O3的纯度为___________ (设产品中杂质只有FeO,保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com