
【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 | Ka1=5.9×10-2 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为。
(4)若0.1mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=mol·L-1(填精确计算结果)。
(5)将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为。
【答案】
(1)c(K+)> c(HC2O4-) >c(H+)>c(C2O42-) >c(OH-)
(2)5
(3)2CO32-+Cl2+H2O = Cl-+ClO-+2HCO3-
(4)9.9×10-7(合理答案给分)
(5)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【解析】(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液中溶质是KHC2O4,溶液呈酸性说明HC2O4-电离程度大于水解程度,再结合氢离子来自HC2O4-的电离和水的电离,所以c(H+)>c(C2O42-) >c(OH-),各离子浓度由大到小的顺序为c(K+)> c(HC2O4-) >c(H+)>c(C2O42-) >c(OH-);
(2)根据CH3COOH的电离平衡常数 ![]() ,把c(CH3COOH)∶c(CH3COO-)=5∶9带入,得c(H+)=1×10-5,所以PH=5;
,把c(CH3COOH)∶c(CH3COO-)=5∶9带入,得c(H+)=1×10-5,所以PH=5;
(3)盐酸、次氯酸的酸性都大于HCO3-,根据强制弱的规律,碳酸钠溶液中滴加少量氯水生成氯化钠、次氯酸钠、碳酸氢钠,反应的离子方程式是2CO32-+Cl2+H2O = Cl-+ClO-+2HCO3-;
(4)pH=8,c(H+)=1×10-8,c(OH-)= ![]() =10-6 ,根据电荷守恒,c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),c(Na+)-c(CH3COO-)= c(OH-)-c(H+)=9.9×10-7;
=10-6 ,根据电荷守恒,c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),c(Na+)-c(CH3COO-)= c(OH-)-c(H+)=9.9×10-7;
(5)标况下44.8L二氧化碳气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,生成等物质的量浓度的碳酸钠、碳酸氢钠溶液, c(CO32-)水解程度大于c(HCO3-),所以c(HCO3-)>c(CO32-),溶液呈碱性,所以c(OH-)>c(H+),故离子大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。
【考点精析】根据题目的已知条件,利用离子积常数的相关知识可以得到问题的答案,需要掌握水的离子积Kw=c(H+)·c(OH–)=10–14(25℃)①Kw只与温度有关,温度升高,Kw增大;如:100℃ Kw=10–12②Kw适用于纯水或稀酸、稀碱、稀盐水溶液中.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空: 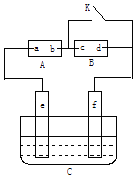
①电源A上的a为极
②欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为: , 电极f上发生的反应为 , 槽中盛放的镀液可以是溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶A和B的混合液,已知A和B的某些性质如下:
物质 | 分子式 | 熔点℃ | 沸点℃ | 密度gcm-3 | 水溶性 |
A | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
B | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
由此,分离A和B的最佳方法是 ( )
A. 萃取 B. 蒸馏 C. 升华 D. 分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不是从安全角度考虑的是
A.用氯酸钾和二氧化锰制氧气时用排水法收集后,应从水中撤出导管后再停止加热
B.酒精灯在不使用时,必须盖上灯帽
C.实验室制备CO气体必须在通风橱中进行
D.蒸馏操作时应在混合液中加入沸石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中是因为发生加成反应而褪色的是( )
A. 苯使溴水褪色 B. 乙炔通入酸性KMnO4溶液后使之褪色
C. 乙烯通入溴水后使溴水褪色 D. 甲苯与酸性KMnO4溶液混合后使之褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 |
下列说法正确的是( )
A. 由实验数据可知实验控制的温度T2>T1
B. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
C. 40min时,表格中T2对应的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池已经成为应用最广泛的可充电电池。某种锂离子电池的结构示意图如下图所示,其中两极区间的隔膜只允许Li+通过。电池放电时的总反应方程式为:
Li1-xCoO2+xLi==LiCoO2。关于该电池的推论错误的是

A. 放电时,Li+主要从负极区通过隔膜移向正板区
B. 放电时,负极反应为:xLi-xe-=xLi+
C. 电解貭溶液不能是水溶液
D. 充电时,负极(C)上锂元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min,铁粉完全溶解。则:
(1)在前2 min内用FeCl2表示的平均反应速率是。
(2)在后4 min内用HCl表示的平均反应速率是。
(3)前2 min与后4 min相比,反应速率较快的是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铅(PbO)是黄色固体。实验室用草酸在浓硫酸作用下分解制备CO,其原理为:H2C2O4![]() CO↑+CO2↑+H2O。某课题组同学设计实验探究CO还原氧化铅并检验氧化产物(已知CO能使银氨溶液产生黑色沉锭)的装置如图所示。下列说法正确的是
CO↑+CO2↑+H2O。某课题组同学设计实验探究CO还原氧化铅并检验氧化产物(已知CO能使银氨溶液产生黑色沉锭)的装置如图所示。下列说法正确的是

A. 实验时,先点燃装置①处酒精灯,当装置⑤中产生连续气泡且有明显现象后再点燃装置③处酒精灯
B. 装置②④⑤中的试剂依次为碱石灰、银氨溶液、澄清石灰水
C. 实验完毕时,先熄灭装置①处酒精灯,再熄灭装置③处酒精灯
D. 尾气处理可选用点燃、气袋收集、NaOH溶液吸收等方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com