
【题目】下列反应中是因为发生加成反应而褪色的是( )
A. 苯使溴水褪色 B. 乙炔通入酸性KMnO4溶液后使之褪色
C. 乙烯通入溴水后使溴水褪色 D. 甲苯与酸性KMnO4溶液混合后使之褪色
科目:高中化学 来源: 题型:
【题目】人们习惯上把电解饱和食盐水的工业叫做氯碱工业. 如图表示电解饱和NaCl溶液的装置,X、Y是石墨棒.实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题: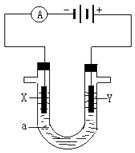
①X极上的电极反应式是 , 在X极附近观察到的现象是;
②Y电极上的电极反应式是 , 检验该电极反应产物的方法是 .
③电解NaCl溶液的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含锰废料(主要成分MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如下:
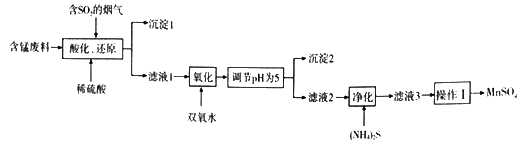
已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如下表所示。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.3×10-33 | 4.0×10-38 | 2.2×10-20 | 1.9×10-14 |
请回答:
(1)沉淀1的化学式为__________________。
(2)室温下,调节pH为5.试通过计算说明此时Al3+、Fe3+已沉淀完全,理由是_________。(NH4)2S的电子式为________________;“净化”时,加入(NH4)2S的作用为___________________。
(3)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为__________________。
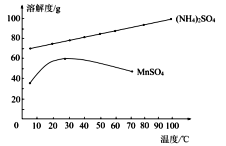
(4)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4。(NH4)2SO4、MnSO4的溶解度曲线如下图所示。
据此判断,操作“I”应为蒸发浓缩、____________、洗涤、干燥。
(5)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为________________。
(6)25.35 g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
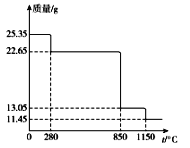
①300℃时,所得固体的化学式为______________________。
②1150℃时,反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 实验室配制FeCl3溶液时,需将FeCl3 (s)溶解在较浓盐酸中,然后加水稀释
B. 反应2CO+2NO = N2+2CO2在常温下能自发进行,则反应的![]() H>0,
H>0,![]() S<0
S<0
C. 0.1mol·L-1NH4Cl溶液加水稀释,c(H+)/c(NH4+)的值增大
D. 反应CH3COOCH3+H2O![]() CH3COOH+CH3OH
CH3COOH+CH3OH ![]() H>0,达到平衡时,加入少量固体NaOH,则乙酸甲酯水解转化率增大
H>0,达到平衡时,加入少量固体NaOH,则乙酸甲酯水解转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能成功的是:
①将乙酸和乙醇混合加热制乙酸乙酯
②苯和浓溴水反应制溴苯
③CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型
④用2mL0.1mol/L的CuSO4溶液和2mL0.1mol/L的NaOH溶液混合,然后加入几滴乙醛,加热,根据是否产生红色沉淀来检验醛基。
A.①②③④ B.①③④ C.①②③ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 | Ka1=5.9×10-2 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为。
(4)若0.1mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=mol·L-1(填精确计算结果)。
(5)将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的某可逆反应,其正反应速率υ(正)和逆反应速率υ(逆)随时间的变化如图所示,下列判断正确的是( )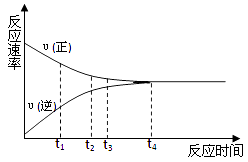
A.t1时刻,υ(正)< υ(逆)
B.t2时刻,υ(正)> υ(逆)
C.t3时刻,υ(正)= υ(逆)
D.t4时刻,υ(正)= υ(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表1是室温下,几种弱酸的电离平衡常数(Ka) 和弱碱的电离平衡常数(Kb)
表1
酸或碱 | 电离常数(ka或kb) |
CH3COOH | 1.75×l0-5 |
柠檬酸 (H3C6H5O7) | Kal=7.4×l0-4 Ka2=1.73×10-5 Ka3=4.0×l0-7 |
NH3·H2O | Kb=1.75×l0-5 |
请回答下面问题:
(1)用蒸馏水稀释0.1mol/L的醋酸溶液,下列选项中一定变小的是____________
A. ![]() B.c(H+) C.c(OH-)·c(H+) D.
B.c(H+) C.c(OH-)·c(H+) D. ![]()
(2)CH3COONH4的水溶液 呈_________(选填“酸性”、“ 中性”、“ 碱性”)。
(3)浓度为0.10mol/L柠檬酸氢二钠(Na2HC6H5O7) 溶液显________(填“酸”、“ 中”、“ 碱”)性,通过计算说明其原因____________。
Ⅱ.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。2CO2(g)-6H2(g)![]() CH3CH2OH(g)+3H2Og) △H=akJ/mol,在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2Og) △H=akJ/mol,在一定压强下,测得上述反应的实验数据如下表。
温度(K) CO2转化率 n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
1.5 | 45% | 33% | 20% | 12% |
2.0 | 60% | 43% | 28% /td> | 15% |
3.0 | 83% | 62% | 37% | 22% |
根据表中数据分析:
①上述反应的α__________0(填“大于” 或“小于”)。
②在一定温度下,提高氢碳(即![]() )比。平衡常数 K值________(填“增大”、“ 减小”、或“不变”)。
)比。平衡常数 K值________(填“增大”、“ 减小”、或“不变”)。
(2) 催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:

在一定温度下,向上述密闭容器中加入1molCO、3molH2及固体催化剂,使之反应。平衡时,反应产生的热量为QkJ,若温度不变的条件下,向上述密闭容器中加入4molCO、12molH2及固体催化剂,平衡时,反应产生的热量为wkJ,则w的范围为___________。
(3)以乙醇蒸气、空气、氢氧化钠溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是__________________。使用上述乙醇燃料电池电解(Pt 电极)一定浓度的Na2CO3溶液,原理如图所示。阳极的电极反应式为____________________,阴极产生的物质A 的化学式为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】树枝化聚合物在生物、医药、催化和光电功能材料等领域有广泛的应用。有机化合物G(3,5-二溴苯甲酸乙酯)是合成树枝化聚合物的重要原料,由A(甲苯)制备H的一种合成路线如下:
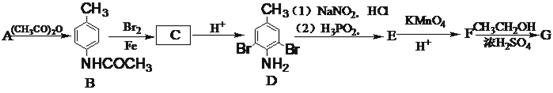
回答下列问题:
(1)E的化学名称为__________。
(2)C的结构简式为____________,F中的官能团名称是__________。
(3)A生成B的反应类型为________。
(4)由F生成G的化学方程式为___________________________________。
(5)G的同分异构体中能同时满足下列条件的共有________种(不含立体异构);
①溴直接与苯环相连,
②苯环只有3个取代基,
③存在酯基官能团。
(6)写出用乙苯为原料制备化合物![]() 的合成路线____________(其他试剂任选)。
的合成路线____________(其他试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com