
【题目】一定条件下的某可逆反应,其正反应速率υ(正)和逆反应速率υ(逆)随时间的变化如图所示,下列判断正确的是( )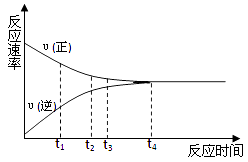
A.t1时刻,υ(正)< υ(逆)
B.t2时刻,υ(正)> υ(逆)
C.t3时刻,υ(正)= υ(逆)
D.t4时刻,υ(正)= υ(逆)
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】废旧锌锰于电池内部的黑色物质A主要含有MnO2、MnOOH、NH4Cl、ZnCl2、炭粉,用A制备高纯MnCO3的流程圈如下:
![]()
(1)锌锰干电池的负极材料是__________(填化学式)。
(2)第I步操作得滤渣的成分是______;第II步在空气中灼烧的目的除了将MnOOH转化为MnO2外,另一作用是__________。
(3)步骤I中制得MnSO4溶液,该反应的化学方程式为____________。用草酸(H2C2O4)而不用双氧水(H2O2)作还原剂的原因是_________。
(4)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;Mn(OH)2开始沉淀时pH为7.7。
第IV步多步操作可按以下步骤进行:
操作l:加入NH4HCO3溶液调节溶液pH<7.7,充分反应直到不再有气泡产生;
操作2:过滤,用少量水洗涤沉淀2~3次;
操作3:检测滤液;
操作4:用少量无水乙醇洗涤2~3次;
操作5:低温烘干。
①操作1发生反应的离子方程式为_________;若溶液pH>7.7,会导致产品中混有____(填化学式)。
②操作3中,检测MnCO3是否洗净的方法是___________。
③操作4用少量无水乙醇洗涤的作用是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:![]() 。在一容积为5L的恒容密闭容器中充入0.2molNO和0.5molCO,5min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是( )
。在一容积为5L的恒容密闭容器中充入0.2molNO和0.5molCO,5min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是( )
A. 达到平衡后,若只升高温度,化学平衡正向移动
B. 达到平衡后,再通入稀有气体,逆反应速率增大
C. 0~5 min内,NO的反应速率为2.4×1 0-3 mol·L一1·min一1
D. 使用催化剂,平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中是因为发生加成反应而褪色的是( )
A. 苯使溴水褪色 B. 乙炔通入酸性KMnO4溶液后使之褪色
C. 乙烯通入溴水后使溴水褪色 D. 甲苯与酸性KMnO4溶液混合后使之褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不需要使用其他试剂,仅通过溶液的相互滴加即可鉴别的溶液是( )
A.AlCl3、NaOHB.H2SO4、KOHC.NaCl、KNO3D.MgCl2、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池已经成为应用最广泛的可充电电池。某种锂离子电池的结构示意图如下图所示,其中两极区间的隔膜只允许Li+通过。电池放电时的总反应方程式为:
Li1-xCoO2+xLi==LiCoO2。关于该电池的推论错误的是

A. 放电时,Li+主要从负极区通过隔膜移向正板区
B. 放电时,负极反应为:xLi-xe-=xLi+
C. 电解貭溶液不能是水溶液
D. 充电时,负极(C)上锂元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是一种强还原性的碱性液体,常用作火箭燃料。利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
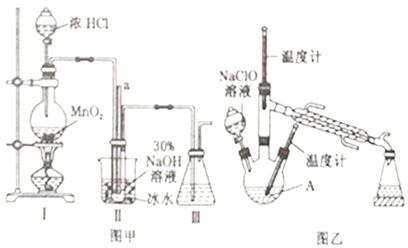
实验1:制备NaClO溶液(己知:3NaClO![]() 2NaCl+NaClO3)。
2NaCl+NaClO3)。
(1)图甲装置Ⅰ中烧瓶内发生反应的离子方程式为________________________。
(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器有_______________。
(3)图甲装置Ⅱ中用冰水浴控制温度的目的是________________________。
实验2:制取水合肼
(4)图乙中若分液漏斗滴液速度过快,部分N2H4·H2O会参与A 中反应并产生大量氮气,降低产品产率,该过程中反应生成氮气的化学方程式为__________________。充分反应后,蒸馏A中溶液即可得到水合肼的粗产品。
实验3:测定馏分中水合肼的含量
(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH 保持在6.5 左右),加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3 滴淀粉溶液。用0.15mol·L-1的碘的标准溶液滴定。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定操作中若不加入适量NaHCO3固体,则测量结果会___________“偏大”“ 偏小”“ 无影响”)。
②下列能导致馏分中水合肼的含量测定结果偏高的是___________(填字母)。
a.锥形瓶清洗干净后未干燥
b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视
d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com