
【题目】能够在酸性溶液中水解,其水解产物互为同分异构体的是( )
A. 麦芽糖 B. 蔗糖 C. 油脂 D. 淀粉
科目:高中化学 来源: 题型:
【题目】一定条件下的某可逆反应,其正反应速率υ(正)和逆反应速率υ(逆)随时间的变化如图所示,下列判断正确的是( )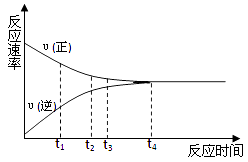
A.t1时刻,υ(正)< υ(逆)
B.t2时刻,υ(正)> υ(逆)
C.t3时刻,υ(正)= υ(逆)
D.t4时刻,υ(正)= υ(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2和CaTiO3都是光电转化材料,某研究小组利用钛铁矿(主要成分为FeTiO3,还含有少量SiO2等杂质)来制备,并利用黄钾矾(KFe3(SO4)2(OH)6)回收铁的工艺流程如下:

回答下列问题:
(1)“氧化酸解”的实验中,控制反应温度为150℃,不同氧化剂对钛铁矿酸解率的影响如图所示。50min时,要求酸解率大于85%,所选氧化剂应为____________;采用H2O2做氧化剂时,其效率低的原因可能是_______________________。
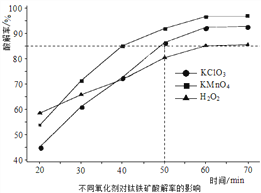
(2)“氧化酸解”的滤液①中加入尿素CO(NH2)2, TiO2+转化为TiO2,写出相应的离子方程式_____________________,使用尿素而不直接通入NH3的原因是_____________。
(3)写出“高温煅烧”中由TiO2制备CaTiO3的化学方程式________________。
(4)使Fe3+恰好沉淀完全时,溶液中c(Fe3+)=1.0×10-5mol·L-1,列式计算此时溶液的pH________。(Fe(OH)3的Ksp=1.0×10-39、水的Kw=1.0×10-14 mol2·L-2)
(5)黄钾钒为沉淀为晶体,含水量很少。回收Fe3+时,不采用加入氨水调节pH制得Fe(OH)3的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】树枝化聚合物在生物、医药、催化和光电功能材料等领域有广泛的应用。有机化合物G(3,5-二溴苯甲酸乙酯)是合成树枝化聚合物的重要原料,由A(甲苯)制备H的一种合成路线如下:
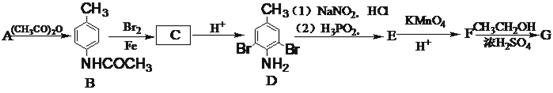
回答下列问题:
(1)E的化学名称为__________。
(2)C的结构简式为____________,F中的官能团名称是__________。
(3)A生成B的反应类型为________。
(4)由F生成G的化学方程式为___________________________________。
(5)G的同分异构体中能同时满足下列条件的共有________种(不含立体异构);
①溴直接与苯环相连,
②苯环只有3个取代基,
③存在酯基官能团。
(6)写出用乙苯为原料制备化合物![]() 的合成路线____________(其他试剂任选)。
的合成路线____________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验报告中记录下列数据,其中正确的是( )
A.用500mL的容量瓶配制450mL溶液B.用托盘天平称量8.75g食盐
C.用25mL量筒量取12.36mL盐酸D.用广泛pH试纸测得某溶液的pH为3.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请参考题中图表,已知E1=134kJ/mol、E2=368kJ/mol,根据要求回答问题:
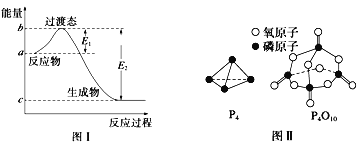
(1)图I是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能最变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”、“减小”或“不变”下同),△H的变化是________。请写出NO2和CO反应的热化学方程式:__________。
(2)如表所示是部分化学键的键能参数:
化学键 | P-P | P-O | O=O | P=O |
键能/kJ/mol | a | b | c | x |
已知白磷的燃烧热为dkJ/mol,白磷及其完全燃烧的产物的结构如图II所示。1个P4O10分子中P-O的个数为_______,表中x=_____kJ/mol(用含a、b、c、d的代表数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯科学家最近合成第114号元素的原子,该原子的质量数为289,存在时间达到30秒,这项成果具有重要意义。该原子的中子数与电子数之差是( )
A.61B.114C.175D.289
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)![]() CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g)![]() CH3OH(g) △H2=-90.7kJ·mol-1
CH3OH(g) △H2=-90.7kJ·mol-1
③2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3
CH3OCH3(g)+H2O(g) △H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3kJ·mol-1、1453.0 kJ·mol-1;1mol液态水变为气态水要吸收44.0kJ的热量。反应③中的相关的化学健键能数据如表:
化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
E/(kJ mol-1) | 436 | 343 | 465 | 453 | 413 |
则△H1=_________kJ·mol-1 △H3=_________ kJ·mol-1
(2)反应③的化学平衡常数表达式为______________。制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是_________________。下列能表明反应①达到化学平衡状态的是_______________。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变

(3)有人模拟制备原理Ⅱ,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是__________;可逆反应③的平衡常数K3=_________。若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)___v(逆),说明原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】埋在地下的输油铸铁管道,在下列各种情况下被腐蚀速度最慢的是( )
A.在含铁元素较多的酸性土壤中
B.在潮湿疏松透气的土壤中
C.在干燥致密不透气的土壤中
D.在含碳粒较多、潮湿透气的土壤中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com