
【题目】汽车尾气净化中的一个反应如下:![]() 。在一容积为5L的恒容密闭容器中充入0.2molNO和0.5molCO,5min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是( )
。在一容积为5L的恒容密闭容器中充入0.2molNO和0.5molCO,5min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是( )
A. 达到平衡后,若只升高温度,化学平衡正向移动
B. 达到平衡后,再通入稀有气体,逆反应速率增大
C. 0~5 min内,NO的反应速率为2.4×1 0-3 mol·L一1·min一1
D. 使用催化剂,平衡常数不变
科目:高中化学 来源: 题型:
【题目】现有化学反应A(g)+B(g)=AB(g)H(反应过程如曲线1所示),当反应体系中加入物质K后反应分两步进行(反应过程如曲线2所示):
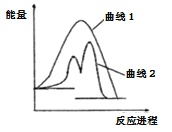
①A(g)+K(g)=AK(g)H1 ②AK(g)+B(g)=AB(g)+K(g)H2,根据图像分析,下列说法正确的是
A. 反应过程中AK(g)是催化剂 B. 加入催化剂会降低反应的H
C. H>0 D. lmolA(g)和1molB(g)的总能量高于1molAB(g)的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含锰废料(主要成分MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如下:
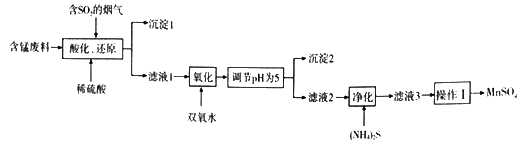
已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如下表所示。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.3×10-33 | 4.0×10-38 | 2.2×10-20 | 1.9×10-14 |
请回答:
(1)沉淀1的化学式为__________________。
(2)室温下,调节pH为5.试通过计算说明此时Al3+、Fe3+已沉淀完全,理由是_________。(NH4)2S的电子式为________________;“净化”时,加入(NH4)2S的作用为___________________。
(3)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为__________________。
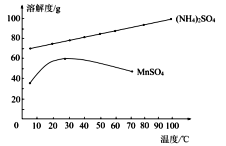
(4)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4。(NH4)2SO4、MnSO4的溶解度曲线如下图所示。
据此判断,操作“I”应为蒸发浓缩、____________、洗涤、干燥。
(5)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为________________。
(6)25.35 g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
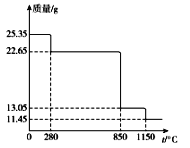
①300℃时,所得固体的化学式为______________________。
②1150℃时,反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、已知34Se的原子结构示意图如图所示,回答下列问题:

(1)Se在元素周期表中的位置是__________。
(2)由Se在周期表中的位置分析判断下列说法正确的是__________。
A.热稳定性:PH3>H2S>H2Se B.还原性:H2Se>HBr>HCl
C.离子半径:Se2->Cl->K+ D.酸性:HClO3>HBrO3>H2SeO3
Ⅱ、已知:X表示卤族元素
(1)HClO的电子式是__________。
(2)氯气通入Ca(OH)2可以制得漂白粉,反应的化学方程式为__________。
(3)共价键的极性随着两元素的非金属性差异增大而增强,HX共价键的极性由强到弱的顺序是__________。
(4)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出BrCl和SO2在水溶液中发生反应的化学方程式__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 实验室配制FeCl3溶液时,需将FeCl3 (s)溶解在较浓盐酸中,然后加水稀释
B. 反应2CO+2NO = N2+2CO2在常温下能自发进行,则反应的![]() H>0,
H>0,![]() S<0
S<0
C. 0.1mol·L-1NH4Cl溶液加水稀释,c(H+)/c(NH4+)的值增大
D. 反应CH3COOCH3+H2O![]() CH3COOH+CH3OH
CH3COOH+CH3OH ![]() H>0,达到平衡时,加入少量固体NaOH,则乙酸甲酯水解转化率增大
H>0,达到平衡时,加入少量固体NaOH,则乙酸甲酯水解转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能成功的是:
①将乙酸和乙醇混合加热制乙酸乙酯
②苯和浓溴水反应制溴苯
③CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型
④用2mL0.1mol/L的CuSO4溶液和2mL0.1mol/L的NaOH溶液混合,然后加入几滴乙醛,加热,根据是否产生红色沉淀来检验醛基。
A.①②③④ B.①③④ C.①②③ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的某可逆反应,其正反应速率υ(正)和逆反应速率υ(逆)随时间的变化如图所示,下列判断正确的是( )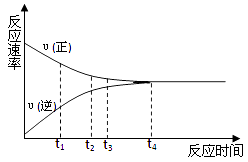
A.t1时刻,υ(正)< υ(逆)
B.t2时刻,υ(正)> υ(逆)
C.t3时刻,υ(正)= υ(逆)
D.t4时刻,υ(正)= υ(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2和CaTiO3都是光电转化材料,某研究小组利用钛铁矿(主要成分为FeTiO3,还含有少量SiO2等杂质)来制备,并利用黄钾矾(KFe3(SO4)2(OH)6)回收铁的工艺流程如下:

回答下列问题:
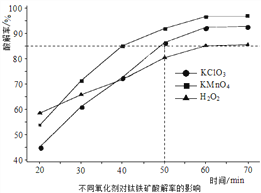
(1)“氧化酸解”的实验中,控制反应温度为150℃,不同氧化剂对钛铁矿酸解率的影响如图所示。50min时,要求酸解率大于85%,所选氧化剂应为____________;采用H2O2做氧化剂时,其效率低的原因可能是_______________________。
(2)“氧化酸解”的滤液①中加入尿素CO(NH2)2, TiO2+转化为TiO2,写出相应的离子方程式_____________________,使用尿素而不直接通入NH3的原因是_____________。
(3)写出“高温煅烧”中由TiO2制备CaTiO3的化学方程式________________。
(4)使Fe3+恰好沉淀完全时,溶液中c(Fe3+)=1.0×10-5mol·L-1,列式计算此时溶液的pH________。(Fe(OH)3的Ksp=1.0×10-39、水的Kw=1.0×10-14 mol2·L-2)
(5)黄钾钒为沉淀为晶体,含水量很少。回收Fe3+时,不采用加入氨水调节pH制得Fe(OH)3的原因是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com