
【题目】现有化学反应A(g)+B(g)=AB(g)H(反应过程如曲线1所示),当反应体系中加入物质K后反应分两步进行(反应过程如曲线2所示):
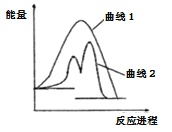
①A(g)+K(g)=AK(g)H1 ②AK(g)+B(g)=AB(g)+K(g)H2,根据图像分析,下列说法正确的是
A. 反应过程中AK(g)是催化剂 B. 加入催化剂会降低反应的H
C. H>0 D. lmolA(g)和1molB(g)的总能量高于1molAB(g)的能量
【答案】D
【解析】A. 根据催化剂催化原理判断;B.催化剂的作用是降低该反应发生所需要的活化能;C. 根据图示判断H的大小;D.根据图示中反应物和生成物具有的能量判断。
根据①A(g)+K(g)=AK(g)和 ②AK(g)+B(g)=AB(g)+K(g)的反应,K是催化剂,AK(g)是催化剂的中间产物,所以A选项错误;催化剂的作用是降低该反应发生所需要的活化能,但不能够改变化学反应的焓变,所以B选项错误; 根据图示,反应物具有较高能量,生成物具有降低能量,该反应是放热反应,H<0,C选项不正确;从题干的图示观察得反应物A和B生成具有的总能量高于生成物AB的总能量,D选项正确;正确选项D。


科目:高中化学 来源: 题型:
【题目】某课外活动小组对采集的酸雨样品进行化验,测得数据如下:c(Na+)=5.0×10-6 mol/L、c(NH4+)=2.0×10-5 mol/L、c(NO3-)=2.0×10-4 mol/L、c(SO42-)=4.0×10-4 mol/L,H+和OH-浓度未测定,则此酸雨的pH约为
A.3 B.4 C.5 D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[Fe(CrO2)2]为原料可制备K2Cr2O7和金属铬。实验流程如下:
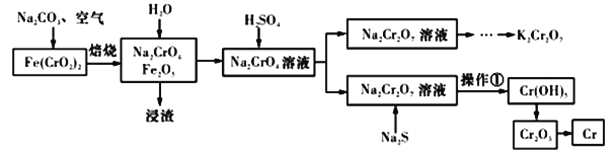
已知:2CrO42-+2H+=Cr2O72-+H2O。pH<3.0,CrO42-含量极小。
(1)写出铬铁矿焙烧转化为Na2CrO4的化学反应方程式:_____________________。焙烧时不能使用陶瓷容器的原因是________________________________________。
(2)判断加入稀硫酸的量已经足量的标准是_______________________________________。
(3)操作①包括过滤和洗涤。实验室洗涤沉淀的操作是________________________________。
(4)Na2S的作用是调节溶液的酸碱度和_____________________。
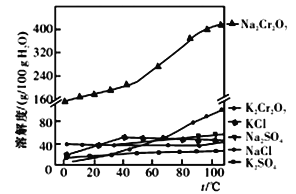
(5)Fe3+在pH为3.7时可完全转化为Fe(OH)3。在上述流程中所得Na2Cr2O7溶液中含有少量Fe3+。请结合上图有关物质的溶解度曲线,设计由Na2Cr2O7溶液制备K2Cr2O7固体的实验方案(实验中须选用的试剂:硫酸溶液、NaOH溶液、KCl固体、蒸馏水):
步骤①除杂质:__________________________________________________________________;
步骤②制备K2Cr2O7固体:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池广泛应用于电动自行车电源,其工作原理如图所示,LixC6和Li1-xFePO4为电极材料,电池反应式为: LixC6+Li1-xFePO4=LiFePO4+6C(x<1)。下列说法错误的是
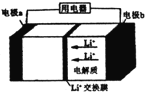
A. 放电时,电极b是负极
B. 放电时,电路中通过0.2mol电子,正极会增重1.4g
C. 充电时,电极a的电极反应式为:6C+xLi++xe-=LixC6
D. 若Li1-xFePO4电极中混有铁单质,会造成电池短路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应适用于工业生产的是
A.电解熔融氯化铝可得到金属铝B.光照氯气和氢气的混合物生产盐酸
C.氯气与石灰乳作用制漂白粉D.二氧化锰和浓盐酸共热,制取氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1 mol/L碳酸钠溶液的叙述正确的是( )
A.溶液中阴离子的物质的量为0.1 mol
B.加水稀释时水解平衡向正反应方向移动,溶液中所有离子浓度均减小
C.升高温度,水解平衡向正反应方向移动
D.加入氢氧化钠固体,可以使溶液中c(Na+):c(CO ![]() 2﹣)=2:1
2﹣)=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧锌锰于电池内部的黑色物质A主要含有MnO2、MnOOH、NH4Cl、ZnCl2、炭粉,用A制备高纯MnCO3的流程圈如下:
![]()
(1)锌锰干电池的负极材料是__________(填化学式)。
(2)第I步操作得滤渣的成分是______;第II步在空气中灼烧的目的除了将MnOOH转化为MnO2外,另一作用是__________。
(3)步骤I中制得MnSO4溶液,该反应的化学方程式为____________。用草酸(H2C2O4)而不用双氧水(H2O2)作还原剂的原因是_________。
(4)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;Mn(OH)2开始沉淀时pH为7.7。
第IV步多步操作可按以下步骤进行:
操作l:加入NH4HCO3溶液调节溶液pH<7.7,充分反应直到不再有气泡产生;
操作2:过滤,用少量水洗涤沉淀2~3次;
操作3:检测滤液;
操作4:用少量无水乙醇洗涤2~3次;
操作5:低温烘干。
①操作1发生反应的离子方程式为_________;若溶液pH>7.7,会导致产品中混有____(填化学式)。
②操作3中,检测MnCO3是否洗净的方法是___________。
③操作4用少量无水乙醇洗涤的作用是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:![]() 。在一容积为5L的恒容密闭容器中充入0.2molNO和0.5molCO,5min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是( )
。在一容积为5L的恒容密闭容器中充入0.2molNO和0.5molCO,5min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是( )
A. 达到平衡后,若只升高温度,化学平衡正向移动
B. 达到平衡后,再通入稀有气体,逆反应速率增大
C. 0~5 min内,NO的反应速率为2.4×1 0-3 mol·L一1·min一1
D. 使用催化剂,平衡常数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com