
【题目】Ⅰ.下表1是室温下,几种弱酸的电离平衡常数(Ka) 和弱碱的电离平衡常数(Kb)
表1
酸或碱 | 电离常数(ka或kb) |
CH3COOH | 1.75×l0-5 |
柠檬酸 (H3C6H5O7) | Kal=7.4×l0-4 Ka2=1.73×10-5 Ka3=4.0×l0-7 |
NH3·H2O | Kb=1.75×l0-5 |
请回答下面问题:
(1)用蒸馏水稀释0.1mol/L的醋酸溶液,下列选项中一定变小的是____________
A. ![]() B.c(H+) C.c(OH-)·c(H+) D.
B.c(H+) C.c(OH-)·c(H+) D. ![]()
(2)CH3COONH4的水溶液 呈_________(选填“酸性”、“ 中性”、“ 碱性”)。
(3)浓度为0.10mol/L柠檬酸氢二钠(Na2HC6H5O7) 溶液显________(填“酸”、“ 中”、“ 碱”)性,通过计算说明其原因____________。
Ⅱ.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。2CO2(g)-6H2(g)![]() CH3CH2OH(g)+3H2Og) △H=akJ/mol,在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2Og) △H=akJ/mol,在一定压强下,测得上述反应的实验数据如下表。
温度(K) CO2转化率 n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
1.5 | 45% | 33% | 20% | 12% |
2.0 | 60% | 43% | 28% /td> | 15% |
3.0 | 83% | 62% | 37% | 22% |
根据表中数据分析:
①上述反应的α__________0(填“大于” 或“小于”)。
②在一定温度下,提高氢碳(即![]() )比。平衡常数 K值________(填“增大”、“ 减小”、或“不变”)。
)比。平衡常数 K值________(填“增大”、“ 减小”、或“不变”)。
(2) 催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:

在一定温度下,向上述密闭容器中加入1molCO、3molH2及固体催化剂,使之反应。平衡时,反应产生的热量为QkJ,若温度不变的条件下,向上述密闭容器中加入4molCO、12molH2及固体催化剂,平衡时,反应产生的热量为wkJ,则w的范围为___________。
(3)以乙醇蒸气、空气、氢氧化钠溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是__________________。使用上述乙醇燃料电池电解(Pt 电极)一定浓度的Na2CO3溶液,原理如图所示。阳极的电极反应式为____________________,阴极产生的物质A 的化学式为____________________。

【答案】 B 中性 酸性 因为Ka3=4.0×10-7,Kh2=1×10-14/ (1.73×10-5)<Ka3 所以显酸性 小于 不变 4Q<w<2E2 CH3CH2OH-12e-+16OH-=2CO32-+11H2O 4CO32--4e-+2H2O=4HCO3-+O2 H2
【解析】Ⅰ.(1)用蒸馏水稀释0.1mol/L的醋酸溶液的过程中,醋酸的电离度变大,但是其电离常数K![]() 不变,
不变,![]() 均变小,故A.
均变小,故A. ![]() 变大; B.c(H+)变小; C.水的离子积c(OH-)·c(H+)不变;D.
变大; B.c(H+)变小; C.水的离子积c(OH-)·c(H+)不变;D. ![]() ,D不变,E变大。综上所述,选项中一定变小的是B 。
,D不变,E变大。综上所述,选项中一定变小的是B 。
(2)由表中数据可知,在室温下醋酸和一水合氨的电离常数相同,故CH3COONH4的水溶液中醋酸根离子和铵根离子的水解程度相同,因此其溶液呈中性。
(3)浓度为0.10mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液,因为Ka3=4.0×10-7,Kh2=1×10-14/ (1.73×10-5)<Ka3 ,即HC6H5O7-水解程度小于其电离程度,所以该溶液显酸性。
Ⅱ.(1)①由表中数据可知,CO2转化率随温度升高而减小,说明该反应为放热反应,故上述反应的α小于0。
②平衡常数只与温度有关,故在一定温度下,提高氢碳(即![]() )比,K值不变。
)比,K值不变。
(2)由图中信息可知,若2molCO和4molH2完全反应生成1mol CH3CH2OH(g)和1mol H2Og),可以放出E2kJ的热量。在一定温度下,向上述密闭容器中加入1molCO、3molH2及固体催化剂,使之反应。平衡时,反应产生的热量为QkJ,若温度不变的条件下,向上述密闭容器中加入4molCO、12molH2及固体催化剂,投料是第一种情况的4倍、压强大于第一种情况,因为增大加压有利于乙醇的生成,所以平衡时,反应产生的热量wkJ>4QkJ,生成的乙醇一定小于2mol,则w<2E2,则w的范围为4Q<w<2E2。
(3)以乙醇蒸气、空气、氢氧化钠溶液为原料,石墨为电极可构成燃料电池,,该电池中负极上的电极反应式是CH3CH2OH-12e-+16OH-=2CO32-+11H2O。使用上述乙醇燃料电池电解(Pt电极)一定浓度的Na2CO3溶液,由图可知,碳酸根转化为碳酸氢根,说明水电离的氢氧根离子放电生成氧气,同时生成的氢离子与碳酸根离子结合生成了碳酸氢根,故阳极的电极反应式为4CO32--4e-+2H2O=4HCO3-+O2↑,阴极上水电离的氢离子放电生成氢气,故物质A的化学式为H2。


科目:高中化学 来源: 题型:
【题目】大约占细胞鲜重总量97%的元素主要是
A.C、H、O、N、P、SB. C、H、O、N、P、K
C.C、H、O、N、Cu、MgD.N、P、S、K、Ca、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中是因为发生加成反应而褪色的是( )
A. 苯使溴水褪色 B. 乙炔通入酸性KMnO4溶液后使之褪色
C. 乙烯通入溴水后使溴水褪色 D. 甲苯与酸性KMnO4溶液混合后使之褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池已经成为应用最广泛的可充电电池。某种锂离子电池的结构示意图如下图所示,其中两极区间的隔膜只允许Li+通过。电池放电时的总反应方程式为:
Li1-xCoO2+xLi==LiCoO2。关于该电池的推论错误的是

A. 放电时,Li+主要从负极区通过隔膜移向正板区
B. 放电时,负极反应为:xLi-xe-=xLi+
C. 电解貭溶液不能是水溶液
D. 充电时,负极(C)上锂元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min,铁粉完全溶解。则:
(1)在前2 min内用FeCl2表示的平均反应速率是。
(2)在后4 min内用HCl表示的平均反应速率是。
(3)前2 min与后4 min相比,反应速率较快的是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是一种强还原性的碱性液体,常用作火箭燃料。利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
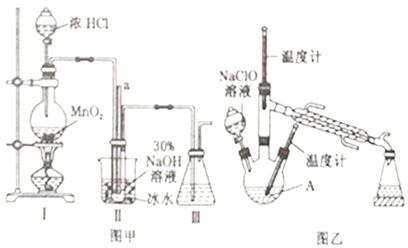
实验1:制备NaClO溶液(己知:3NaClO![]() 2NaCl+NaClO3)。
2NaCl+NaClO3)。
(1)图甲装置Ⅰ中烧瓶内发生反应的离子方程式为________________________。
(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器有_______________。
(3)图甲装置Ⅱ中用冰水浴控制温度的目的是________________________。
实验2:制取水合肼
(4)图乙中若分液漏斗滴液速度过快,部分N2H4·H2O会参与A 中反应并产生大量氮气,降低产品产率,该过程中反应生成氮气的化学方程式为__________________。充分反应后,蒸馏A中溶液即可得到水合肼的粗产品。
实验3:测定馏分中水合肼的含量
(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH 保持在6.5 左右),加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3 滴淀粉溶液。用0.15mol·L-1的碘的标准溶液滴定。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定操作中若不加入适量NaHCO3固体,则测量结果会___________“偏大”“ 偏小”“ 无影响”)。
②下列能导致馏分中水合肼的含量测定结果偏高的是___________(填字母)。
a.锥形瓶清洗干净后未干燥
b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视
d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行如下了实验。
利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再通过滴定测量。
实验装置如图所示。

(1)a的作用是____________,仪器d的名称是________________ 。
(2)检查装置气密性:____________(填操作),关闭k,微热c,导管e末端有气泡冒出;停止加热,导管e内有一段稳定的水柱,说明装置气密性良好。
(3)c中加入一定体积高氯酸和mg氟化稀土样品,Z中盛有滴加酚酞的NaOH溶液。加热b、c,使b中产生的水蒸气进入c。
①下列物质可代替高氯酸的是_________(填序号)。
A.硝酸 B.盐酸 C.硫酸 D.磷酸
②实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成。若有SiF4生成,实验结果将__________(填“偏高”“ 偏低”或“不受影响”)。
③若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因是______________。
(4)向馏出液中加入V1mL c1mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用c2mol·L-1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1:1络合),消耗EDTA标准溶液V2ml,则氟化稀土样品中氟的质量分数为______________。
(5)用样品进行实验前,需要用0.084g氟化钠代替样品进行实验,改变条件(高氯酸用量、反应温度、蒸馏时间),测量并计算出氟元素质量,重复多次。该操作的目的是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com