
【题目】下图所示各烧杯中盛有海水,铁在其中被腐蚀的速率由快到慢的顺序为( )。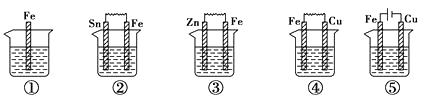
A.⑤②①③④
B.④③①②⑤
C.⑤④②①③
D.③②④①⑤
【答案】C
【解析】判断金属腐蚀快慢,首先判断该金属是充当原电池还是电解池的电极,若是电解池的阳极,金属腐蚀速率最快,其次是充当原电池的负极腐蚀较快,而作为电解池的阴极和原电池的正极不被腐蚀。其中第⑤,Fe作为电解池的阳极,腐蚀最快,②③④均为原电池,第③中,Fe为正极,不被腐蚀,②④中Fe均为负极被腐蚀,Fe和Cu的金属活动性差别较Fe和Sn大,④中铁腐蚀较快,其腐蚀速率由快到慢的顺序为⑤④②①③。
所以答案是:C
【考点精析】掌握金属的电化学腐蚀与防护是解答本题的根本,需要知道金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 实验室配制FeCl3溶液时,需将FeCl3 (s)溶解在较浓盐酸中,然后加水稀释
B. 反应2CO+2NO = N2+2CO2在常温下能自发进行,则反应的![]() H>0,
H>0,![]() S<0
S<0
C. 0.1mol·L-1NH4Cl溶液加水稀释,c(H+)/c(NH4+)的值增大
D. 反应CH3COOCH3+H2O![]() CH3COOH+CH3OH
CH3COOH+CH3OH ![]() H>0,达到平衡时,加入少量固体NaOH,则乙酸甲酯水解转化率增大
H>0,达到平衡时,加入少量固体NaOH,则乙酸甲酯水解转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表1是室温下,几种弱酸的电离平衡常数(Ka) 和弱碱的电离平衡常数(Kb)
表1
酸或碱 | 电离常数(ka或kb) |
CH3COOH | 1.75×l0-5 |
柠檬酸 (H3C6H5O7) | Kal=7.4×l0-4 Ka2=1.73×10-5 Ka3=4.0×l0-7 |
NH3·H2O | Kb=1.75×l0-5 |
请回答下面问题:
(1)用蒸馏水稀释0.1mol/L的醋酸溶液,下列选项中一定变小的是____________
A. ![]() B.c(H+) C.c(OH-)·c(H+) D.
B.c(H+) C.c(OH-)·c(H+) D. ![]()
(2)CH3COONH4的水溶液 呈_________(选填“酸性”、“ 中性”、“ 碱性”)。
(3)浓度为0.10mol/L柠檬酸氢二钠(Na2HC6H5O7) 溶液显________(填“酸”、“ 中”、“ 碱”)性,通过计算说明其原因____________。
Ⅱ.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。2CO2(g)-6H2(g)![]() CH3CH2OH(g)+3H2Og) △H=akJ/mol,在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2Og) △H=akJ/mol,在一定压强下,测得上述反应的实验数据如下表。
温度(K) CO2转化率 n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
1.5 | 45% | 33% | 20% | 12% |
2.0 | 60% | 43% | 28% /td> | 15% |
3.0 | 83% | 62% | 37% | 22% |
根据表中数据分析:
①上述反应的α__________0(填“大于” 或“小于”)。
②在一定温度下,提高氢碳(即![]() )比。平衡常数 K值________(填“增大”、“ 减小”、或“不变”)。
)比。平衡常数 K值________(填“增大”、“ 减小”、或“不变”)。
(2) 催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:

在一定温度下,向上述密闭容器中加入1molCO、3molH2及固体催化剂,使之反应。平衡时,反应产生的热量为QkJ,若温度不变的条件下,向上述密闭容器中加入4molCO、12molH2及固体催化剂,平衡时,反应产生的热量为wkJ,则w的范围为___________。
(3)以乙醇蒸气、空气、氢氧化钠溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是__________________。使用上述乙醇燃料电池电解(Pt 电极)一定浓度的Na2CO3溶液,原理如图所示。阳极的电极反应式为____________________,阴极产生的物质A 的化学式为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列物质的转化,回答下列问题:
(1)乙烯的结构式为:。
(2)写出化合物官能团的化学式及名称:
B中含官能团名称;D中含官能团名称。
(3)写出反应类型
①反应;②反应;③反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2和CaTiO3都是光电转化材料,某研究小组利用钛铁矿(主要成分为FeTiO3,还含有少量SiO2等杂质)来制备,并利用黄钾矾(KFe3(SO4)2(OH)6)回收铁的工艺流程如下:

回答下列问题:
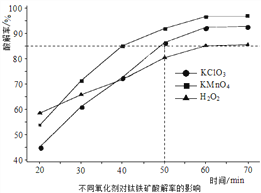
(1)“氧化酸解”的实验中,控制反应温度为150℃,不同氧化剂对钛铁矿酸解率的影响如图所示。50min时,要求酸解率大于85%,所选氧化剂应为____________;采用H2O2做氧化剂时,其效率低的原因可能是_______________________。
(2)“氧化酸解”的滤液①中加入尿素CO(NH2)2, TiO2+转化为TiO2,写出相应的离子方程式_____________________,使用尿素而不直接通入NH3的原因是_____________。
(3)写出“高温煅烧”中由TiO2制备CaTiO3的化学方程式________________。
(4)使Fe3+恰好沉淀完全时,溶液中c(Fe3+)=1.0×10-5mol·L-1,列式计算此时溶液的pH________。(Fe(OH)3的Ksp=1.0×10-39、水的Kw=1.0×10-14 mol2·L-2)
(5)黄钾钒为沉淀为晶体,含水量很少。回收Fe3+时,不采用加入氨水调节pH制得Fe(OH)3的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性.纳米泡沫碳与金刚石的关系是( )
A.同一种物质
B.同分异构体
C.同位素
D.同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】树枝化聚合物在生物、医药、催化和光电功能材料等领域有广泛的应用。有机化合物G(3,5-二溴苯甲酸乙酯)是合成树枝化聚合物的重要原料,由A(甲苯)制备H的一种合成路线如下:
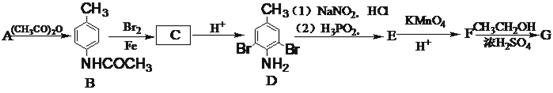
回答下列问题:
(1)E的化学名称为__________。
(2)C的结构简式为____________,F中的官能团名称是__________。
(3)A生成B的反应类型为________。
(4)由F生成G的化学方程式为___________________________________。
(5)G的同分异构体中能同时满足下列条件的共有________种(不含立体异构);
①溴直接与苯环相连,
②苯环只有3个取代基,
③存在酯基官能团。
(6)写出用乙苯为原料制备化合物![]() 的合成路线____________(其他试剂任选)。
的合成路线____________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请参考题中图表,已知E1=134kJ/mol、E2=368kJ/mol,根据要求回答问题:
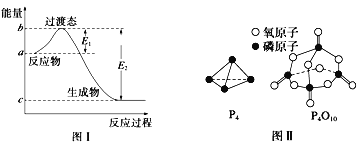
(1)图I是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能最变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”、“减小”或“不变”下同),△H的变化是________。请写出NO2和CO反应的热化学方程式:__________。
(2)如表所示是部分化学键的键能参数:
化学键 | P-P | P-O | O=O | P=O |
键能/kJ/mol | a | b | c | x |
已知白磷的燃烧热为dkJ/mol,白磷及其完全燃烧的产物的结构如图II所示。1个P4O10分子中P-O的个数为_______,表中x=_____kJ/mol(用含a、b、c、d的代表数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某主族元素的原子,M层上有一个半充满的亚层(即该亚层的每个轨道只有1个电子),这种原子的质子数
A. 只能是7 B. 只能是15 C. 是11或15 D. 是11或13
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com