
【题目】下列有关反应的叙述不正确的是
A.有元素化合价发生变化的反应一定是氧化还原反应
B.分解反应的反应物只有一种
C.化合反应的生成物只有一种
D.有单质生成的反应一定是置换反应
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
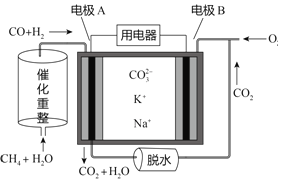
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移8mol电子
3H2+CO,每消耗1molCH4转移8mol电子
B. 电池工作时,CO32-向电极A移动
C. 电极A上只有H2参与电极反应,反应式为H2+2OH--2e-=2H2O
D. 电极B上发生的电极反应为O2+4e-=2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L,其pH与溶液体积的关系如图所示,下列说法正确的是( )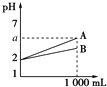
①A是强酸或比B强的弱酸,B是弱酸
②稀释后,A溶液的酸性比B溶液强
③若A、B均为弱酸,则2<a<5
④若A、B均为强酸,则A、B的物质的量浓度一定相等.
A.①②
B.①③
C.①③④
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 | K1=9.1×10-8 | K1=7.5×10-3 |
则下列说法中不正确的是( )
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸, ![]() 增大
增大
D.向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年4月26日,海军成立68周年时,我国第一艘国产航母成功下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+最高能级电子的运动状态有_________种,铬元素在周期表中_____区。
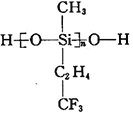
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如下图所示),其中C原子杂化方式为__________杂化。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是__________(填元素符号)
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
②根据价层电子对互斥理论,预测ClO3-的空间构型为__________形,写出一个C1O3-的等电子体的化学符号__________________。
③已知高碘酸有两种形式,化学式分别为H5IO6(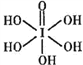 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
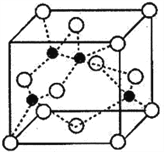
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶体结构如图所示(黑球表示Zn2+,白球表示S2-)。则该晶体中与Zn2+等距且最近的S2-形成的立体图形为______________________。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,该晶体中Zn2+和S2-原子之间的最短距离为体对角线的1/4,则该晶体中S2-和Zn2+之间的最短距离为__________________pm。(写出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】21世纪是纳米科技崭露头角的时代。下列分散系的分散质粒子直径在1nm~100nm之间的是
A.盐酸B.蔗糖溶液C.油水混合物D.Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,晶体(“具有”或“不具有”)规则的几何外形和固定的熔点,非晶态物质则相反。常见的氯化钠、纯碱属于___(填“晶体”或“非晶态物质”,下同),而玻璃、石蜡属于___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废水需处理与检测。
I.已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s)ΔH1
H2(g)+2O2(g)=H3AsO4(s)ΔH1
H2(g)+![]() O2(g)=H2O(l)ΔH2
O2(g)=H2O(l)ΔH2
2As(s)+![]() O2(g) =As2O5(s)ΔH3
O2(g) =As2O5(s)ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH=_______________。
II.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
 已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为______;砷酸的第一步电离方程式为_____________。
(2)“一级沉砷”中FeSO4的作用是_______________; “二级沉砷”中H2O2与含砷物质反应的化学方程式为_________。
III.去除水体中的砷,将As(Ⅲ)转化为As(Ⅴ),也可选用NaClO实现该转化。研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:

已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸。产生此结果的原因是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题进行作答:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 ( )
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
C.2CO(g)+O2(g)=2CO2(l)△H<0
D.2H2(g)+O2(g)═2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据(1)中所选反应设计一个原电池,其正极的电极反应式为:
(3)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是:
(4)利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于 (填M或者N)处,此时溶液中的阴离子向 极(填X或铁)移动.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com