
【题目】通常情况下,晶体(“具有”或“不具有”)规则的几何外形和固定的熔点,非晶态物质则相反。常见的氯化钠、纯碱属于___(填“晶体”或“非晶态物质”,下同),而玻璃、石蜡属于___。
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如下流程转化为粗As2O3。
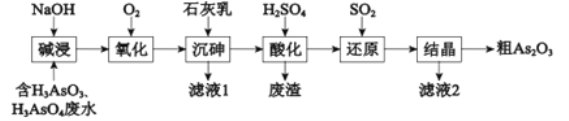
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐.H3AsO4转化为Na3AsO4反应的化学方程式是__________.
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2___________.
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq)△H<0
Ca2+(aq)+2OH-(aq)△H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃.高于85℃后,随温度升高,沉淀率________(填“提高”或“下降”)。用化学平衡原理解释其原因是_________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_________.
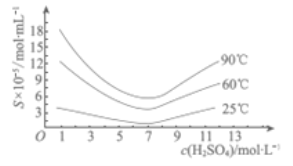
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3.As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如右图所示.为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是___________.
(6)下列说法中,正确的是__________(填字母).
a.粗As2O3中含有CaSO4
b.工业生产中,滤液1、2和废渣一同弃掉
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1 mol CO2 的质量为44g/mol
B.H2SO4的摩尔质量为98
C.标准状况下,气体摩尔体积约为22.4 L
D.O2的相对分子质量为32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应的叙述不正确的是
A.有元素化合价发生变化的反应一定是氧化还原反应
B.分解反应的反应物只有一种
C.化合反应的生成物只有一种
D.有单质生成的反应一定是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷、甲醇都是清洁能源。
(1)已知下列热化学方程式
①CO2(g)+3H2(g)=CH3OH(g) +H2O (g)△H= -49.0 kJ/mol
②CH4(g)+2O2(g)=2H2O(g) +CO2(g) △H= -802.3 kJ/mol
③2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
④H2O(g)=H2O(l) △H= -44.0 kJ-mol
则CH4(g)+1/2O2(g)=CH3OH(g) △H =____________。
(2)工业上合成甲醇的另一种方法是2H2(g)+CO(g) ![]() CH3OH(g) △H。
CH3OH(g) △H。
一定温度下在3个体积均为1.0 L的恒容密闭容器中发生上述反应,相关物理量见下表:
容器 | 温度/K | 物质的起始浓度/molL-1 | 物质的平衡浓度/mol.L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
①该反应的△H______0(填“>”或“<”)。
②达到平衡时,容器I中c(CH3OH)_____0.16mol/L(填“>” “<” 或“=”)。
③400 K 时该反应的平衡常数K=________。
(3)文献报道某课题组利用CO2催化缺化制甲烷的研究过程如下:
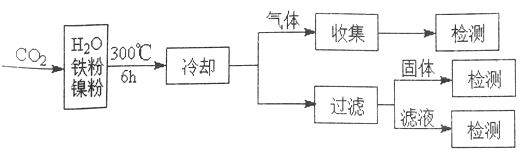
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2 的产量和镍粉用量的关系如下图所示(仪改变镍粉用量,其他条件不变)。研究人员根据实验结果得出结论:HCOOH 是CO2转化为CH4 的中间体,即:![]()
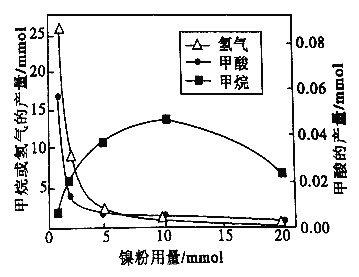
①写出产生H2的反应方程式_________。
②由图可知,镍粉是_______(填字母)。
a.反应I的催化剂 b.反应II 的催化剂
c.反应I和II的催化剂 d.不是催化剂
③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是______(填字母)。
a.反应1的速率增加,反应II的速率不变
b.反应I的速率不变,反应II的速率增加
c.反应I、II的速率均不变
d.反应I、II的速率均增加,且反应I的速率增加得快
e.反应I、II的速率均增加,且反应II 的速率增加得快
f.反应I的速率减小,反应II的速率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验事故或废弃药品的处理方法不正确的是
A.当有大量毒气泄漏时,人应沿逆风方向疏散
B.实验室里电线失火,首先要断开电源
C.当少量浓硫酸沾在皮肤上,应立即用3%-5%氢氧化钠溶液冲洗
D.酒精失火用湿抹布盖灭
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com