
【题目】下列物质属于电解质的是( )
A.Cu
B.硝酸钾溶液
C.AgCl
D.NH3
科目:高中化学 来源: 题型:
【题目】通常情况下,晶体(“具有”或“不具有”)规则的几何外形和固定的熔点,非晶态物质则相反。常见的氯化钠、纯碱属于___(填“晶体”或“非晶态物质”,下同),而玻璃、石蜡属于___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究铁发生电化学腐蚀的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化(结果如图2).下列叙述错误的是( )
A.图2中,t2时容器中压强明显小于起始压强是因为铁粉发生了吸氧腐蚀
B.碳粉表面的电极反应式只有:2H2O+O2+4e﹣═4OH﹣
C.碳粉表面一定发生了还原反应
D.图3中,发生腐蚀时电子转移方向如箭头所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题进行作答:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 ( )
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
C.2CO(g)+O2(g)=2CO2(l)△H<0
D.2H2(g)+O2(g)═2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据(1)中所选反应设计一个原电池,其正极的电极反应式为:
(3)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是:
(4)利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于 (填M或者N)处,此时溶液中的阴离子向 极(填X或铁)移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是(△H的绝对值均正确)( )
A.C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5KJmol﹣1(燃烧热)
O2(g)═CO(g)△H=﹣110.5KJmol﹣1(燃烧热)
B.C2H5OH+3O2═2CO2+3H2O△H=﹣1368.8KJmol﹣1(反应热)
C.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O (l)△H=﹣114.6KJmol﹣1(中和热)
D.2H2O(g)═2H2(g)+O2(g)△H=+483.6KJmol﹣1(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(1)已知上述反应中相关的化学键键能数据如下:
化学键 | C-H | C=O | H-H | C≡O(CO) |
键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
则该反应的△H=______kJ·mol-1。
(2)为了加快该反应的速率,可以进行的措施是(_____)。
A.恒温恒压下,按原比例充入CH4、CO2
B.恒温下,缩小容器体积
C.增大反应物与催化剂的接触面积
D.降低温度
(3)恒温下,向2L体积恒定的容器中充入一定量的CO2、CH4,使其在催化剂作用下进行反应,经tmin后,测得CO有amol,则v(CO2)=______。下列各项能说明该反应达到平衡的是(______)。
A.容器内气体密度保持一定 B.容器内CO2、CH4的浓度之比为1∶1
C.该反应的正反应速率保持一定 D.容器内气体压强保持一定
(4)用甲烷作燃料的碱性燃料电池中,电极材料为多孔惰性金属电极,则负极的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定利用CO2对减少温室气体排放意义重大。CO2加氢合成甲醇是CO2综合利用的一条新途径。CO2和H2在催化剂作用下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0
CH3OH(g)+H2O(g) ΔH<0
(1)测得甲醇的理论产率与反应温度、压强的关系如图所示。
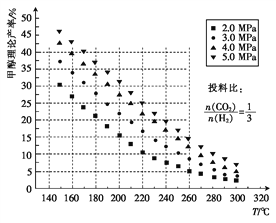
①下列措施能使CO2的转化率提高的是____(填序号)。
A.增大压强 B.升高温度 C.增大H2投料比 D.用更高效的催化剂
②在220℃、5.0MPa时,CO2、H2的转化率之比为___________。
③将温度从220℃降低至160℃,压强从5.0MPa减小至3.0MPa,化学反应速率将_____(填“增大”“减小”或“不变”下同),CO2的转化率将_____。
④200℃时,将0.100 mol CO2和0.275 mol H2充入1 L密闭容器中,在催化剂作用下反应达到平衡。若CO2的转化率为25%,,则此温度下该反应的平衡常数表达式K=_____________(只用数字填,不必计算出结果)。
(2)若H2(g)和CH3OH(l)的燃烧热分别为-285.8kJ·mol﹣1和-726.5kJ·mol﹣1,则由CO2和H2生成液态甲醇和液态水的热化学方程式为________________________________。
(3)甲醇电解法制氢气比电解水法制氢气的氢的利用率更高、电解电压更低。电解装置如图。
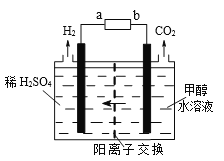
电源的正极为_____(填序号a或b)。其中阳极的电极反应式为_________________;标况下,每消耗1mol甲醇则生成H2的体积为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应N2(g)+3H2(g)2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内H2的反应速率为( )
A.1.2mol/(Lmin)
B.1.8 mol/(Lmin)
C.0.6mol/(Lmin)
D.2.4mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
TaS2(g)+2I2(g)![]() TaI4(g)+S2(g)
TaI4(g)+S2(g)
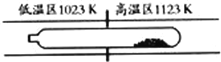
下列说法正确的是 ( )
A.在不同温度区域,TaI4 的量保持不变
B.在提纯过程中,I2 的量不断减少
C.在提纯过程中,I2的作用是将TaS2 从高温区转移到低温区
D.该正反应的平衡常数与TaI4 和S2 的浓度乘积成反比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com