
����Ŀ���̶�����CO2�Լ������������ŷ������ش�CO2����ϳɼ״���CO2�ۺ����õ�һ����;����CO2��H2�ڴ��������·�����Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H<0
CH3OH(g)+H2O(g) ��H<0
��1����ü״������۲����뷴Ӧ�¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
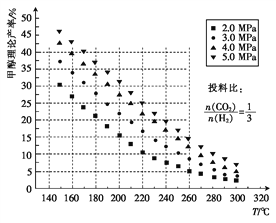
�����д�ʩ��ʹCO2��ת������ߵ���____������ţ���
A������ѹǿ B�������¶� C������H2Ͷ�ϱ� D���ø���Ч�Ĵ���
����220�桢5.0MPaʱ��CO2��H2��ת����֮��Ϊ___________��
�۽��¶ȴ�220�潵����160�棬ѹǿ��5.0MPa��С��3.0MPa����ѧ��Ӧ���ʽ�_____���������С�����䡱��ͬ����CO2��ת���ʽ�_____��
��200��ʱ,��0.100 mol CO2��0.275 mol H2����1 L�ܱ������У��ڴ��������·�Ӧ�ﵽƽ�⡣��CO2��ת����Ϊ25%,������¶��¸÷�Ӧ��ƽ�ⳣ������ʽK=_____________��ֻ����������ؼ�����������
��2����H2(g)��CH3OH(l)��ȼ���ȷֱ�Ϊ-285.8kJ��mol��1��-726.5kJ��mol��1������CO2��H2����Һ̬�״���Һ̬ˮ���Ȼ�ѧ����ʽΪ________________________________��
��3���״���ⷨ�������ȵ��ˮ������������������ʸ��ߡ�����ѹ���͡����װ����ͼ��
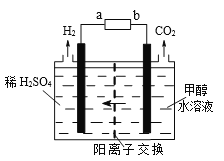
��Դ������Ϊ_____�������a��b)�����������ĵ缫��ӦʽΪ_________________������£�ÿ����1mol�״�������H2�����Ϊ____��
���𰸡� AC 1��1 ��С ���� ![]() CO2(g)+3H2(g)
CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ��H= -130.9kJ��mol-1 b CH3OH+H2O��6e��=CO2+6H+ 67.2L
CH3OH(l)+H2O(l) ��H= -130.9kJ��mol-1 b CH3OH+H2O��6e��=CO2+6H+ 67.2L
����������1����A.���������������С�ķ�Ӧ����ѹƽ�������ƶ���CO2��ת������ߣ���A��ȷ��B.�÷�ӦΪ���ȷ�Ӧ������������ƽ�������ƶ���CO2��ת���ʽ��ͣ���B����C.����H2Ͷ�ϱ�������ƽ�������ƶ���CO2��ת������ߣ���C��ȷ��D.ʹ�ô���ƽ�ⲻ�ƶ�����D����ΪAC���ڸ���ͼ��֪�״������۲���Ϊ25%��CO2��H2��Ͷ�ϱ�Ϊ1:3���뷴Ӧ��ϵ����һ�£����ԣ�CO2��H2��ת����֮�����Ϊ1:1�����¶�Խ�͡�ѹǿԽС����Ӧ����ԽС���۲�ͼ�е����ݿ�֪����140�棬2MPaʱ���״��IJ��ʸ���25%�����Զ�����̼��ת���ʸ���25%��������̼��ת����������������ʽ���㣺
CO2+3H2CH3OH+H2O
��ʼ(mol/L)0.10.27500
ת��(mol/L)0.0250.0750.0250.025
ƽ��(mol/L)0.0750.20.0250.025
����![]()
��2����H2��g����ȼ������HΪ-285.8kJmol-1֪��1molH2��g����ȫȼ������1molH2O��l���ų�����285.8kJ������H2��g��+![]() O2��g��=H2O��l����H=-285.8kJmol-1����CH3OH��l��+
O2��g��=H2O��l����H=-285.8kJmol-1����CH3OH��l��+![]() O2��g��=CO2��g��+2 H2O��l����H=-726.5kJmol-1���ɸ�˹���ɿ�֪��3����-�ڵ�CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=-130.9kJmol-1���ʴ�Ϊ��CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=-130.9kJmol-1��
O2��g��=CO2��g��+2 H2O��l����H=-726.5kJmol-1���ɸ�˹���ɿ�֪��3����-�ڵ�CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=-130.9kJmol-1���ʴ�Ϊ��CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=-130.9kJmol-1��
��3�����ݲ���ͼʾ���Ӧ������Һ�е������ӵõ��������������ó����Ϊ�����ұ�Ϊ�������ʵ�ԴaΪ������bΪ�����������Ϸ����״�ʧ���ӱ�ɶ�����̼�ķ�Ӧ��������Ե���ʣ��������缫��ӦΪCH3OH+H2O��6e��=CO2+6H+��ÿ����1mol�״�ת��6mol���ӣ���������3mol�����������ɵ�����Ϊ3mol�����Ϊ67.2L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������У�������ͬ�����������
A.�����ͳ���B.˫��ˮ��ˮ
C.���Ͱ���D.̼60(C60)��ʯī
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2��g��+O2��g��2SO3��g����H=a kJmol��1 �� ��Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g����ȫת��Ϊ1mol SO3��g������99kJ����ش�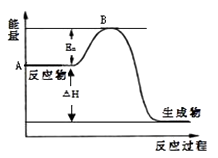
��1��ͼ��A���ʾ �� a= ��
��2��Ea�Ĵ�С�Ը÷�Ӧ�ġ�H����С����ޡ���Ӱ�죮
��3����֪���³�ѹ�µ������ȼ����Ϊ296kJmol��1 �� �ɵ������������������Ӧ������3mol SO3��g�����ų���������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Li2CO3��K2CO3Ϊ����ʣ���Ȼ���������������ṩ��Ӧ����ȼ�ϵ������ͼ������˵����ȷ����
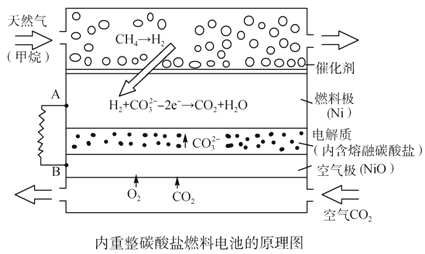
A. �Դ˵��Ϊ��Դ��⾫��ͭ������0.1 mol e�� ת��ʱ����3.2 gͭ�ܽ�
B. ���Լ���Ϊȼ����ʱ�����缫��Ӧʽ��CH4+5O2����8e��=CO32-+2H2O
C. �õ��ʹ�ù������貹��Li2CO3��K2CO3
D. �����������ĵ缫��ӦʽΪO2��4e����2CO2===2CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʽṹ�����ʡ�����BP����һ���ܹ�ע����ĥͿ����ϣ�����Ϊ�ѵȽ�������ı�����Ĥ��
��1�����廯������廯������ڸ�����������H2��Ӧ�����Ƶ�BP��
��������Ӧ�Ļ�ѧ����ʽΪ________________________��
����ԭ���д���_____�ֲ�ͬ�����ĵ��ӣ�����ռ�ݵ�����ܲ����Ϊ_______��
�۳����£����廯���ǵ���ɫ����Һ�壬�����ڱ�ͪ�����Ȼ�̼�У�����������______���壨������ͣ���
��2����֪��������ǿ�ᣬ���������pKa= -lgKa��
���л��������ǿ�����ڽ�̼��ȡ��ԭ�ӵ�Ӱ��,�����ԣ�BrCH2COOH >CH3COOH���ݴ��Ʋ⣬pKa��AtCH2COOH____ClCH2COOH���>������<������=����
����������Ԫ�ᣬд��������PO43-������ͬ�ռ乹�ͺͼ�����ʽ�ķ��ӻ�����_________________��
��������һԪ�ᣬ����ˮ�б��ֳ����������ԣ�������������������������£�����ˮ������B(OH)3��ϣ�����һ��������ӣ��������ӵĽṹʽΪ��_________����������λ�������ü�ͷ�������
��3�������մɲ���Si3N4�ijɼ���ʽ��ͼ1��ʾ���ṹ��N��Si��N�ļ��DZ�Si��N��Si�ļ��Ǵ���ԭ����_____________________________________��
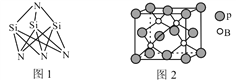
��4������ľ���ṹ��ͼ2��ʾ��������Pԭ�ӵĶѻ���ʽΪ________��������������������������������������ܡ����ѻ������þ��������ڽ�������Pԭ��֮��ľ���Ϊa nm�������ܶ�Ϊ__________g��cm-3��ֻ���г�����ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Q��X��Y��ZΪ������Ԫ�أ����������ڱ��е�λ����ͼ��ʾ��
X | Y | ||
Q | Z |
��4��Ԫ�ص�ԭ������������֮��Ϊ22���ݴ˻ش��������⣺
(1)Q�ĵ��ʳ����������뵼�壬��Q��Ԫ�����ڱ��е�λ��Ϊ________��
(2)X����ͼ��⻯��ĽṹʽΪ__________��
(3)Q��X��Z����ۺ������У�������ǿ����____________��
(4)X��Y����3��Ԫ���γɵĻ������мȺ������Ӽ��ֺ��й��ۼ�����________(��дһ�ֵĻ�ѧʽ)��
(5)X�ļ��⻯����Y�ĵ����ڴ����������·�Ӧ��������������÷�Ӧ�Ļ�ѧ����ʽΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ͪ��һ��ҽҩ�м��壬��ṹ��ʽ��ͼ��ʾ������˵����ȷ����( )
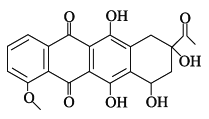
A. ÿ�����ͪ�����к��� 1 ������̼ԭ�ӣ������ĸ���ͬ���ŵ�̼ԭ�ӣ�
B. ���ͪ���������е�̼ԭ�Ӷ���ͬһ��ƽ����
C. һ�����������ͪ�ɷ����������ӳɡ���ȥ��Ӧ
D. 1 mol ���ͪ������ 4 mol �����ᷢ��ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ĿǰΪֹ���ɻ�ѧ��ת������ܻ������Ȼ������ʹ������Ҫ����Դ��
��1����ѧ��Ӧ�зų������ܣ��ʱ䣬��H���뷴Ӧ���������ļ��ܣ�E���йأ���֪��H2��g��+Cl2��g��=2HCl��g����H=��a kJmol��1��E��H��H��=b kJmol��1 �� E��Cl��Cl��=c kJmol��1 �� ��E��H��Cl��=��
��2����ԭ�Ӷ�O3�ķֽ��д����ã�O3��g��+Cl��g��=ClO��g��+O2��g����H1 �� ClO��g��+O��g��=Cl��g��+O2��g����H2 �� ����������ķֽⷴӦ��O3+O=2O2��H���÷�Ӧ�������仯ʾ��ͼ��ͼ1��ʾ����ӦO3��g��+O��g��=2O2��g��������Ӧ�Ļ��ΪkJmol��1 �� 
��3��ʵ���в���ֱ�Ӳ����ʯī��������Ӧ���ɼ��鷴Ӧ�ķ�Ӧ�ȣ����ɲ��CH4��ʯī��H2ȼ�շ�Ӧ�ķ�Ӧ�ȣ�����ʯī���ɼ���ķ�Ӧ�ȣ���֪��
��CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=��a kJmol��1
��C��ʯī��+O2��g���TCO2��g����H=��b kJmol��1
��H2��g��+ ![]() O2��g���TH2O��l����H=��c kJmol��1
O2��g���TH2O��l����H=��c kJmol��1
��ӦC��ʯī��+2H2��g����CH4��g���ķ�Ӧ�ȣ�
��H=kJmol��1 ��
����֪���÷�ӦΪ���ȷ�Ӧ����H��T��S����Ϊ��Ӧ������оݣ�����H��T��S��0ʱ���Է����У���÷�Ӧ��ʲô�����¿��Է����� �� ������¡��������¡���
��4����ͼ2��ʾ��װ�ã���װ����Cu��Ϊ������ͭƬ�������仯Ϊ12.8gʱ��a�������ĵ�O2�ڱ�״���µ����ΪL��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com