
����Ŀ��Q��X��Y��ZΪ������Ԫ�أ����������ڱ��е�λ����ͼ��ʾ��
X | Y | ||
Q | Z |
��4��Ԫ�ص�ԭ������������֮��Ϊ22���ݴ˻ش��������⣺
(1)Q�ĵ��ʳ����������뵼�壬��Q��Ԫ�����ڱ��е�λ��Ϊ________��
(2)X����ͼ��⻯��ĽṹʽΪ__________��
(3)Q��X��Z����ۺ������У�������ǿ����____________��
(4)X��Y����3��Ԫ���γɵĻ������мȺ������Ӽ��ֺ��й��ۼ�����________(��дһ�ֵĻ�ѧʽ)��
(5)X�ļ��⻯����Y�ĵ����ڴ����������·�Ӧ��������������÷�Ӧ�Ļ�ѧ����ʽΪ_______��
���𰸡� �����ڣ���A�� ![]() HClO4 NH4NO3��NH4NO2 4NH3+5O2
HClO4 NH4NO3��NH4NO2 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
������������Ԫ�������ڱ��е�λ�ÿ�֪X��Yλ�ڵڶ����ڣ�Q��Zλ�ڵ������ڡ���Q��������������n����X��Y��Z��ԭ�������������ֱ���n+1��n+2��n+3����n+n+1+n+2+n+3��22�����n��4������X��N��Y��O��Z��Cl��Q��Si�����Ԫ�������ɺ�������ʵ����ʽ��
�������Ϸ�����֪X��N��Y��O��Z��Cl��Q��Si����
(1)��ĵ��ʳ����������뵼�壬��Ԫ�ص�ԭ��������14����Ԫ�����ڱ��е�λ��Ϊ�������ڵڢ�A�塣
(2)X����ͼ��⻯���ǰ������ṹʽΪ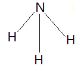 ��
��
(3)�ǽ�����Խǿ��ۺ����������Խǿ�����Q��X��Z����ۺ������У�������ǿ����HClO4��
(4)N��O��H3��Ԫ���γɵĻ������мȺ������Ӽ��ֺ��й��ۼ�����NH4NO3��NH4NO2)��
(5)X�ļ��⻯����Y�ĵ����ڴ����������·�Ӧ������������������Ĵ��������÷�Ӧ�Ļ�ѧ����ʽΪ4NH3+5O2![]() 4NO+6H2O��
4NO+6H2O��


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪298Kʱ��Ksp(NiS)��1.0��10-21��Ksp(NiCO3)��1.0��10-7 ��p(Ni)����lg c(Ni2+)��p(B)����lg c(S2-)����lg c(CO32-)���ں����ʵ���Ũ����ͬ��Na2S��Na2CO3�Ļ����Һ�еμ�Ni(NO3)2��Һ�������ֳ�������Һ�������ӡ�������Ũ�ȹ�ϵ��ͼ��ʾ������˵���������

A. ������NiCO3���ܽ�ȴ���NiS���ܽ��
B. ��d���Ӧ����Һ�м����Ӧ�����ӵ����Σ�d����b���ƶ�
C. ��������I����b����ȣ�b����c���ƶ�
D. PΪ3.5�Ҷ�Ӧ����������CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��д��ȷ���ǣ���H�ľ���ֵ����ȷ����������
A.C��s��+ ![]() O2��g���TCO��g����H=��110.5KJmol��1��ȼ���ȣ�
O2��g���TCO��g����H=��110.5KJmol��1��ȼ���ȣ�
B.C2H5OH+3O2�T2CO2+3H2O��H=��1368.8KJmol��1����Ӧ�ȣ�
C.2NaOH��aq��+H2SO4��aq���TNa2SO4��aq��+2H2O ��l����H=��114.6KJmol��1���к��ȣ�
D.2H2O��g���T2H2��g��+O2��g����H=+483.6KJmol��1����Ӧ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̶�����CO2�Լ������������ŷ������ش�CO2����ϳɼ״���CO2�ۺ����õ�һ����;����CO2��H2�ڴ��������·�����Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H<0
CH3OH(g)+H2O(g) ��H<0
��1����ü״������۲����뷴Ӧ�¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
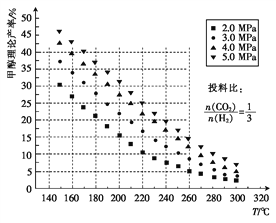
�����д�ʩ��ʹCO2��ת������ߵ���____������ţ���
A������ѹǿ B�������¶� C������H2Ͷ�ϱ� D���ø���Ч�Ĵ���
����220�桢5.0MPaʱ��CO2��H2��ת����֮��Ϊ___________��
�۽��¶ȴ�220�潵����160�棬ѹǿ��5.0MPa��С��3.0MPa����ѧ��Ӧ���ʽ�_____���������С�����䡱��ͬ����CO2��ת���ʽ�_____��
��200��ʱ,��0.100 mol CO2��0.275 mol H2����1 L�ܱ������У��ڴ��������·�Ӧ�ﵽƽ�⡣��CO2��ת����Ϊ25%,������¶��¸÷�Ӧ��ƽ�ⳣ������ʽK=_____________��ֻ����������ؼ�����������
��2����H2(g)��CH3OH(l)��ȼ���ȷֱ�Ϊ-285.8kJ��mol��1��-726.5kJ��mol��1������CO2��H2����Һ̬�״���Һ̬ˮ���Ȼ�ѧ����ʽΪ________________________________��
��3���״���ⷨ�������ȵ��ˮ������������������ʸ��ߡ�����ѹ���͡����װ����ͼ��
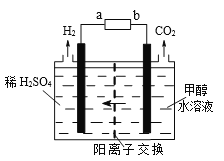
��Դ������Ϊ_____�������a��b)�����������ĵ缫��ӦʽΪ_________________������£�ÿ����1mol�״�������H2�����Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������п��������ˮ��Ӧ�����߶���PH3���壨�۵�Ϊ-132�棬��ԭ��ǿ������ȼ������������ʳѬ��ɱ�档������ȫ���涨������ʳ�������PH3�ƣ��ĺ�������0.05mg��kg-1ʱ��ϸ������·����ⶨ��ʳ�в��������ﺬ����
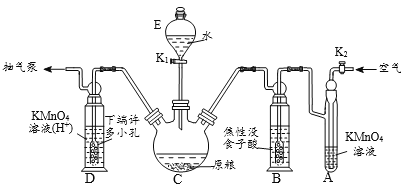
���������̡���װ����װ�á�PH3�IJ��������ա�ת��KMnO4������Һ���������Ʊ���Һ�ζ���
��ʵ��װ�á�C��ʢ100 gԭ����D��ʢ�� 20.00 mL 1.12��10-4 mol L-1KMnO4�ܣ�H2SO4�ữ)��
��ش��������⣺
��1������C��������_________��ԭ������ȴ�ɷ�ĩ����ԭ����_____________��
��2��������ˮ��Ӧ�л�ѧ����ʽΪ_____________________________________���������װ�����������õķ�����_______________________________________��
��3��A��ʢװKMnO4��Һ�������dz�ȥ�����еĻ�ԭ�����壻B��ʢװ����ûʳ����ļ�����Һ�������������տ����е�O2����ֹ___________��ͨ�������������____________��
��4��D��PH3�����������ᣬ��������Ӧ�����ӷ���ʽΪ_________________________��
��5����D������Һת��������ƿ�У���ˮϡ����250mL��ȡ25.00mL����ƿ�У���5.0��10-5mol L-1��Na2SO3����Һ�ζ�ʣ���KMnO4��Һ�����ı�Na2SO3��Һ11.00mL�����ԭ���������PH3�ƣ��ĺ���Ϊ______mg kg-1����ԭ������________����ϸ��ϸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������·�ӦN2��g��+3H2��g��2NH3��g ����10L���ܱ������н��У����2min�ڣ�N2�����ʵ�����20mol��С��8mol����2min��H2�ķ�Ӧ����Ϊ��������
A.1.2mol/��Lmin��
B.1.8 mol/��Lmin��
C.0.6mol/��Lmin��
D.2.4mol/��Lmin��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��ʵ����
A.��Ԫ�صĵ���ʧB.���ӵĵ�ʧ����Ӷ�ƫ��
C.���ϼ۵�����D.������ԭ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����������������Ⱦ���������·�Ӧ��CH4��g��+2NO2��g��N2��g��+CO2��g��+2H2O��g����H=a kJ/mol ���¶�T1��T2ʱ���ֱ�0.50mol CH4��1.2mol NO2�������Ϊ1L���ܱ������У����n��CH4����ʱ��仯�������±�������˵������ȷ���ǣ�������
�¶� | ʱ��/min | 0 | 10 | 20 | 40 | 50 |
T1 | n��CH4�� | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n��CH4�� | 0.50 | 0.30 | 0.18 | �� | 0.15 |
A.10 min�ڣ�T1ʱCH4�Ļ�ѧ��Ӧ���ʱ�T2ʱС
B.�¶ȣ�T1��T2
C.a��0
D.ƽ�ⳣ����K��T1����K��T2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��г��ˢ١�������Ԫ�������ڱ��е�λ�ã�

(1)��Ԫ�غ͢�Ԫ�ؿ����γ�����л���仯ѧʽΪ____��
(2)��Ԫ��ԭ�ӵ�����������Ϊ____��
(3)��Ԫ�����Ԫ���γɵĻ�����ĵ���ʽΪ____��д��һ�ּ��ɣ���
(4)�ڡ��ۡ�������Ԫ�صķǽ�������____�������������ǿ������
(5)��Ԫ�غ͢�Ԫ���γɵ��⻯����ȶ��Ե�ǿ��˳��Ϊ_________���ѧʽ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com