
【题目】硫酸亚铁铵品体[(NH4)2Fe(SO4)2·6H2O]又称摩尔盐,是一种重要的化工原料,用途十分广泛。
(1)基态Fe2+的核外电子排布式为_____________________。
(2)氨是合成摩尔盐的重要原料,工业合成氨中,原料气在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收其中的杂质CO气体,其反应方程式为:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)](Ac-=CH3COO-)
[Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)](Ac-=CH3COO-)
①醋酸中碳原子的杂化方式是_________,1mol乙酸分子中含有σ键的数目为_________________。
②C、N、O三种元素的第一电离能由小到大的顺序为___________________________。
③与CO互为等电子体的分子为___________(填化学式),NH3的空间构型为__________________。
(3)N和P都是第VA族元素,其最简单氢化物熔点的大小关系为_________,主要原因是__________________________________。
(4)铁在不同温度范围有不同的晶体结构。室温下铁是简单立方,称为α铁(α-Fe)。当温度升高到912℃,α铁转变为面心立方,称为γ铁(γ-Fe)。当温度继续升高到1394 ℃,γ铁转变为体心立方。称为δ铁(δ-Fe)。

①γ铁晶体中铁原子配位数是____________________。
②δ铁晶体密度为dg·cm-3,则其晶胞参数(边长)为__________cm(阿伏加德罗常数用NA表示)。
【答案】 1s22s22p63s23p63d6或[Ar]3d6 sp2、sp3 7NA(或7×6.02×1023) C<O<N N2 三角锥形 NH3>PH3 NH3分子间存在氢键 12 ![]()
【解析】(1)Fe是26号元素,根据核外电子排布规律,可以写出其基态Fe2+核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6,答案为:1s22s22p63s23p63d6或[Ar]3d6
(2)①甲基(-CH3)中碳原子形成4个单键,杂化轨道数目为4,采用的是sp3杂化;羧基(-COOH)中碳原子形成3个σ键,杂化轨道数目为3,采用的是sp2杂化;CH3COOH分子中单键都是σ键,双键中一个是σ键一个是π键,所以1个醋酸分子一共有7个σ键,1mol乙酸分子含有7molσ键,σ键的数目为7NA(或7×6.02×1023)②同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由小到大的顺序为:C<O<N③等电子体是指具有相同价电子数目和原子数目的分子或离子,与CO互为等电子体的分子为N2;NH3中心原子N为sp3杂化,有一对孤对电子,所以空间构型为三角锥形。答案为:① sp2、sp3 、 7NA(或7×6.02×1023) ② C<O<N ③ N2 、 三角锥形
(3)N和P都是第VA族元素,但是氮元素是活泼的非金属元素,在氨气分子间存在氢键,所以其最简单氢化物NH3比pH3易液化,熔沸点比pH3高。答案为:NH3>PH3 、NH3分子间存在氢键
(4)①γ-Fe晶体晶胞类型为面心立方,位于顶点的Fe原子,被晶胞的三个平面共有,每个平面与其距离相等的Fe原子数目为4,则共有3×4=12,故配位数为12②根据δ铁晶体晶胞的结构图可以知道,晶胞中含有Fe原子数为:1+![]() =2,设晶胞的边长为acm,则a3
=2,设晶胞的边长为acm,则a3![]() d
d![]() NA=56
NA=56![]() ,所以a=
,所以a=![]() cm,答案为:12 、
cm,答案为:12 、![]()


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是
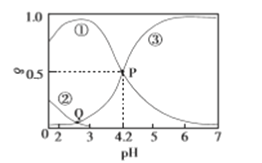
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. Q点对应的溶液中lgc(H+)<lgc(OH-)
C. 20℃时,H2C2O4的一级电离平衡常数Ka1=1×10-4.2
D. 0.100mol/L的NaHC2O4溶液中:c(OH-)=c(H+)- c(C2O42-)+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. H2、D2互为同位素
B. CH3CH2CH2CH2CH3和CH3CH2CH(CH3)2互为同素异形体
C. 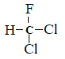 和
和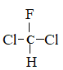 为同一物质
为同一物质
D. CH3CH2OH和CH2OHCHOHCH2OH具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KNO3固体中少量的KCl,有以下可供选择的8个操作:
①过滤 ②萃取 ③固体溶于水 ④冷却结晶 ⑤蒸发浓缩 ⑥干燥 ⑦洗涤 ⑧分液
从中选出正确的操作且排序正确的是( )
A.⑤④①B.③②⑧C.③①⑦⑥D.③⑤④①⑦⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂酸性废液中含有Fe3+、Al3+、Fe2+、SO42-,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略):
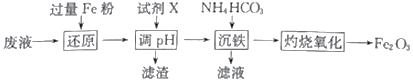
已知:①NH4HCO3在热水中会分解。
②常温下,溶液中不同金属离子生成氢氧化物沉淀时的pH见下表:
金属离子(0.1mol·L-l) | Fe3+ | Fe2+ | Al3+ |
开始沉淀时的pH | 2.4 | 7.6 | 3.4 |
完全沉淀时的pH | 3.7 | 9.6 | 4.8 |
回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:_________________________________。
(2)试剂X可选用_________(任写一种,填化学式),“滤渣”的主要成分是_________________。
(3)加入碳酸氢铵后过滤,发现滤液仍然浑浊,可能的原因是_________________________,用90℃热水洗涤FeCO3沉淀的目的是______________________________________。
(4)若在实验室中灼烧FeCO3应在_____________(填仪器名称)中进行,“灼烧氧化”发生的化学方程式为__________________________________。
(5)若工业上灼烧氧化174.0吨FeCO3得到117.6吨产品,则该产品中Fe2O3的纯度为___________ (设产品中杂质只有FeO,保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应SO2+O2=2SO3在密闭容器中进行。下列关于该反应的说法正确的是
A. 增大压强能减慢反应速率
B. v(SO2):v(O2)=2:1证明该反应已达到化学平衡状态
C. 当反应物和生成物浓度不变时,反应已达平衡
D. 增大02的浓度可使SO2完全转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液滴定10 mL 0.1 mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是
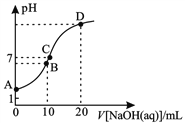
A. A点溶液中加入少量水:![]() 增大
增大
B. B点:c( HA -)>c(H+)>c(A2一)>c(H2A)
C. 水电离出来的c(OH -):B点>D点
D. C点:c(Na+) =c(HA-)+2c( A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究氨、乙醇的性质,某同学设计并进行了下列实验。
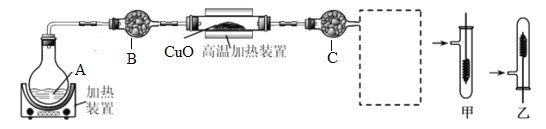
请回答:
(1)仪器B的名称为_____________。
(2)为快速制备氨气,A中应加入的试剂为______,B中应放入的试剂为_______。
(3)若A中加入乙醇,B中加入生石灰,C中加入无水硫酸铜,反应一段时间后,C中的现象为_________。经检测反应中既生成了乙醛,又生成了少量乙酸。请写出乙醇与氧化铜反应生成乙醛的化学方程式_____________________。
(4)在(3)中实验里,某同学为检验尾气中是否含有乙醇,虚线框处宜选择的装置是______(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入试管中,观察到铜丝由黑渐渐变红,由此可得出的结论是____________________。(并简述其理由)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com