
����Ŀ��
��1����֪����CO��g��+ ![]() O2��g��=CO2��g����H=-283.0kJmol-1
O2��g��=CO2��g����H=-283.0kJmol-1
��CH3OH��l��+ ![]() O2��g��=CO2��g��+2H2O��l����H=-726.5kJmol-1
O2��g��=CO2��g��+2H2O��l����H=-726.5kJmol-1
��д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ�� ��
��2����ѧ���ѻ���˼��������о������N4���ӣ���ṹΪ�������壨��ͼ��ʾ��������������ƣ���֪����1molN-N������193kJ����������1molN��N������941kJ��������1molN4����ת��Ϊ2molN2ʱ�ġ�H= ��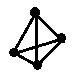
���𰸡�
��1��CH3OH��l��+O2��g���TCO��g��+2H2O��l����H=-443.5kJ?mol-1
��2��-724kJ?mol-1
����������1����֪����CO��g��+ ![]() O2��g��=CO2��g����H=-283.0kJmol-1 ����CH3OH��l��+
O2��g��=CO2��g����H=-283.0kJmol-1 ����CH3OH��l��+ ![]() O2��g��=CO2��g��+2H2O��l����H=-726.5kJmol-1 ���ڣ��ٵ�CH3OH��l��+O2��g���TCO��g��+2H2O��l�������H= -726.5kJmol-1 -��-283.0kJmol-1��= -443.5kJmol-1 ���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪCH3OH��l��+O2��g���TCO��g��+2H2O��l����H=-443.5kJmol-1��
O2��g��=CO2��g��+2H2O��l����H=-726.5kJmol-1 ���ڣ��ٵ�CH3OH��l��+O2��g���TCO��g��+2H2O��l�������H= -726.5kJmol-1 -��-283.0kJmol-1��= -443.5kJmol-1 ���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪCH3OH��l��+O2��g���TCO��g��+2H2O��l����H=-443.5kJmol-1��
��2����1molN4����ת��Ϊ2molN2ʱ��Ҫ����6molN-N�����γ�2molN��N������֪����1molN-N������193kJ����������1molN��N������941kJ��������1molN4����ת��Ϊ2molN2ʱ�ġ�H=��193 ![]() -941
-941 ![]() ��kJmol-1 = -724kJmol-1��
��kJmol-1 = -724kJmol-1��


 ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д� �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ��������ˮϡ��1 mol/L�Ĵ�����Һ��0.01 mol/L��������Һ��ϡ�ͣ����и�����ʼ�ձ����������( )
A.![]()
B.![]()
C.![]()
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. �����к�����ḻ��Ԫ������Ԫ��
B. �����к�����ḻ��Ԫ������Ԫ��
C. �����к�������Ԫ������Ԫ��
D. �ؿ��к������Ľ���Ԫ������Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ȷ���ǣ� ��
A.����������ʹNaCl����Һ������ʱ��Ӧ���ȱ߽���ֱ����Һ����
B.��10mL��Ͳ��ȡ8.58mL����ˮ
C.����ƿ����ʱ�۲�Һ��ʱ���ӣ���ʹ��õ���ҺŨ��ƫ��
D.�þƾ���ȡ��ˮ�е�I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ҫ���������ԣ����о���Ȼ����Ϳ�����ҩ����Ҫ��Դ�� (c)��
(c)��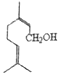 (n)��
(n)�� (t)��Ϊ��������������˵������ȷ����
(t)��Ϊ��������������˵������ȷ����
A. c��n��Ϊͬ���칹�� B. n������̼ԭ�ӿ��ܴ���ͬһƽ��
C. c��n��t�����Է����ۺϷ�Ӧ D. c��n��t����ʹ����KMnO4��Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20��ʱ����H2C2O4��NaOH�����Һ����c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L����̼Ԫ�����ķֲ�����������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
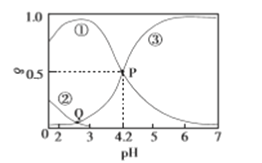
A. ����ʾH2C2O4�ķֲ�����������ʾC2O42-�ķֲ�����
B. Q���Ӧ����Һ��lgc(H+)<lgc(OH-)
C. 20��ʱ��H2C2O4��һ������ƽ�ⳣ��Ka1=1��10-4.2
D. 0.100mol/L��NaHC2O4��Һ�У�c(OH-)=c(H+)- c(C2O42-)+c(H2C2O4)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ���Ȼ���(SnCl4)�������л��ϳɵ��Ȼ�������ʵ���ҿ������ڵ���(�۵�231.9C)��Cl2 ��Ӧ�Ʊ�SnCl4װ������ͼ��ʾ��
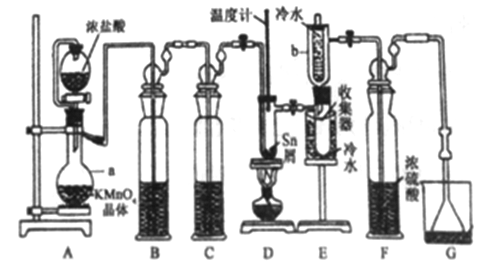
��֪���� SnCl4�ڿ����м���ˮ������SnO2xH2O����SnCl2��SnCl4�й������������±���
���� | ��ɫ��״̬ | �۵�/�� | �е�/�� |
SnCl2 | ��ɫ���� | 246 | 652 |
SnCl4 | ��ɫҺ�� | -33 | 114 |
�ش�����������
��1������a��������__________�����з�����Ӧ�����ӷ���ʽΪ________��
��2��װ��B��C ��ʢװ���Լ��ֱ���_______��__________��
��3�����۲쵽װ��FҺ���Ϸ�����_____����ʱ�ſ�ʼ��ȼ�ƾ��ƣ������ۻ����ʵ����������������������ȡ���ʱ�������ȵ�Ŀ���������ӿ�����������Ӧ����__________��
��4��Eװ����b��������___________��
��5�����Ƶò�Ʒ�к�������Cl2����ɲ�������_____(����ĸ)��ʩ���Գ�ȥ��
A.����NaOH ��ȡ��Һ B.�����������ټ�������
C.����⻯���������� D.���뱥��ʳ��ˮ��ȡ
��6�����õζ����ⶨ����Ʒ�Ĵ��ȡ�ȷ��ȡ����Ʒmg���뵽����Ũ�����ܽ⣬Ȼ���ټ�ˮϡ����250 mL������Һ����ȡ25.00 ml��ϡ�ͺ����Һ����ƿ�У��������ε�����Һ��ָʾ�ƣ���cmol/L ��KIO3 ����Һ���еζ���ƽ�еζ�3 �Σ�ƽ������V mL�ı���Һ����֪�ζ�ʱ�����ķ�ӦΪ:Sn2++IO3-+H+��Sn4++I2+H2O(δ��ƽ)���ش�����������
���жϴﵽ�ζ��յ������Ϊ____________��
����Ʒ��SnCl2(Ħ������ΪM g/mol )�ĺ���Ϊ____%(�ú�m��c��V��M �Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥKNO3������������KCl�������¿ɹ�ѡ���8��������
�ٹ��� ����ȡ �۹�������ˮ ����ȴ�ᾧ ������Ũ�� ���� ��ϴ�� ���Һ
����ѡ����ȷ�IJ�����������ȷ���ǣ� ��
A.�ݢܢ�B.�ۢڢ�C.�ۢ٢ߢ�D.�ۢݢܢ٢ߢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com