
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9C)与Cl2 反应制备SnCl4装置如下图所示。
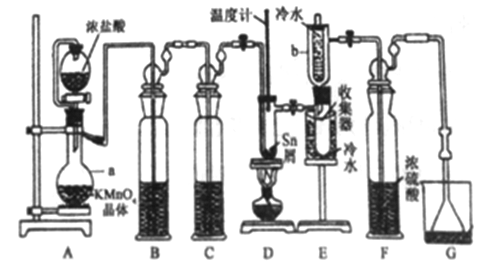
已知,① SnCl4在空气中极易水解生成SnO2xH2O;②SnCl2、SnCl4有关物理性质如下表。
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
回答下列问题:
(1)仪器a的名称是__________,其中发生反应的离子方程式为________。
(2)装置B、C 中盛装的试剂分别是_______、__________。
(3)当观察到装置F液面上方出现_____现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的有:①加快氯气与锡反应,②__________。
(4)E装置中b的作用是___________。
(5)若制得产品中含有少量Cl2,则可采用下列_____(填字母)措施加以除去。
A.加入NaOH 萃取分液 B.加入足量锡再加热蒸馏
C.加入碘化钾冷凝过滤 D.加入饱和食盐水萃取
(6)可用滴定法测定最后产品的纯度。准确称取该样品mg加入到适量浓盐酸溶解,然后再加水稀释至250 mL,用移液管移取25.00 ml,稀释后的溶液于锥形瓶中,加入两滴淀粉溶液作指示制,用cmol/L 的KIO3 标准溶液进行滴定,平行滴定3 次,平均消耗V mL的标准溶液。已知滴定时发生的反应为:Sn2++IO3-+H+→Sn4++I2+H2O(未配平)。回答下列问题:
①判断达到滴定终点的现象为____________。
②产品中SnCl2(摩尔质量为M g/mol )的含量为____%(用含m、c、V、M 的代数式表示)。
【答案】 蒸馏烧瓶 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O 饱和食盐水 浓硫酸 黄绿色气体时 使SnCl4气化,利于从混合物中分离出来 冷凝回流SnCl4、导气 B 当滴入最后一滴KIO3标准溶液时,锥形瓶中的溶液恰好由无色变为蓝色,且半分钟内不褪色 ![]()
【解析】考查实验方案设计与评价,(1)根据仪器a的特点,仪器a为蒸馏烧瓶,装置A的作用是制备氯气,利用高锰酸钾的强氧化性,把Cl-氧化成Cl2,即离子方程式为2MnO4-+ 16H+ + 10Cl-=2Mn2+ +5Cl2 ↑+8H2O;(2)装置A中制备的氯气中混有HCl和水蒸气,对后续实验产生干扰,必须除去,因此装置B中盛放饱和食盐水,装置C中盛放浓硫酸;(3)点燃酒精灯之前,先通一段时间的氯气,排除装置中空气,即F液面上方出现黄绿色气体,再点燃酒精灯;装置E的作用是收集SiCl4,因此装置D的作用是制备SiCl4,继续加热的目的是①加快反应速率,②使SiCl4气化,利于从混合物中分离出来;(4)E装置中b的作用是冷凝回流SiCl4、导气;(5)A、SiCl4极易水解,因此不能用NaOH溶液,除去SiCl4的氯气,故A错误;B、加入足量的锡与氯气反应,生成SnCl2,根据表格中数据,再加热蒸馏,故B正确;C、加入的碘化钾与氯气反应,生成I2和KCl,产品中混有I2,故C错误;D、加入饱和食盐水,不能吸收Cl2,故D错误;(6)①根据滴定时的反应,I2能与Sn2+发生反应生成Sn4+和I-,滴定到终点的现象:当滴入最后一滴KIO3标准液时,锥形瓶中的溶液由无色变为蓝色,且30s或半分钟不褪色;②根据得失电子数目守恒,V×10-3×c×6=n(Sn2+)×2,解得n(Sn2+)=3Vc×10-3mol,250mL溶液中n(Sn2+)=3×10-2Vcmol,即SnCl2的含量为![]() %。
%。


科目:高中化学 来源: 题型:
【题目】(1)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为______;若XY2为共价化合物时,其结构式为_____。
(2)现有a~g7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:
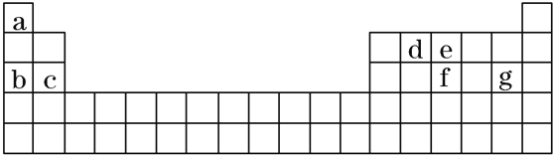
①元素的原子间反应最容易形成离子键的是_____(填序号,下同),容易形成共价键的是___。
A.c和f B.b和g C.d和g D.b和e
②写出a~g7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式___。
(3)将2moH2O和2molCO置于1L容器中,在一定条件下加热至高温,发生如下可逆反应:2H2O(g)![]() 2H2(g)+O2(g)、2CO(g)+O2(g)
2H2(g)+O2(g)、2CO(g)+O2(g)![]() 2CO2(g)。
2CO2(g)。
①当上述系统达到平衡时,欲求其混合气体的平衡组成。则至少还需婴知道两种气体的平衡浓度,但这两种气体不能同时是______或______。
②若平衡时O2和CO2的物质的量分别为n(O2)甲=amol,n(CO2)甲=bmol。试求n(H2O)甲=_____(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)已知:①CO(g)+ ![]() O2(g)=CO2(g)△H=-283.0kJmol-1
O2(g)=CO2(g)△H=-283.0kJmol-1
②CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=-726.5kJmol-1
O2(g)=CO2(g)+2H2O(l)△H=-726.5kJmol-1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为2molN2时的△H= 。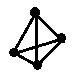
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土有工业“黄金”之称,我国稀土资源丰富。目前从氟碳铈矿(主要化学成分为CeFCO3)提取铈族稀土元素的冶炼处理工艺已经发展到十几种,其中一种提取铈的工艺流程如下:

已知:①焙烧后烧渣中含+4价的铈及+3价的其它稀土氟氧化物:
②Ce4+能与SO42-结合成CeSO4,Ce4+能被萃取剂[(HA)2]萃取。
请回答下列问题:
(1)CeFCO3中,Ce元素的化合价为_____。
(2)“酸浸I”过程中CeO2转化为Ce3+,且产生黄绿色气体,用稀硫酸和H2O2,替换HCl就不会造成环境污染。则稀硫酸.H2O2与CeO2反应的离子方程式为:__________。
(3)“沉淀”步骤中发生的反应为:Ce(BF4)3(s)+3KCl(aq)=3KBF4(s)+CeCl3(aq)。已知Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数为______(用含a、b的代数式表示)。
(4)“浸出液”中含有少量Ce4+及其他稀土元素的离子,可以通过“萃取”与“反萃取寻探作进一步分离、富集各离子。“萃取”时Ce4+与萃取剂[(HA)2]存在的反应为:Ce4++n(HA)2![]() Ce(H2a-4A2a)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2a-4A2a)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-),D随浸出液中c(SO42-)增大而减小的原因是__________。
)其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-),D随浸出液中c(SO42-)增大而减小的原因是__________。
(5)“操作I”后,向溶液中加入NaOH溶液,调节溶液的pH可获得Ce(OH)3沉淀,当溶液中离子浓度小于1.0×10-6mol/L视为沉淀完全,常温下加入NaOH调节溶液的pH应大于_______[已知:Ce(OH)3的Ksp=8.0×10-21;1g2=-0.3]
(6)写出“氧化”步骤的化学方程式:_______________。
(7)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧在尾气消除过程中发生着CeO2![]() CeO2(1-x) +xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:________________。
CeO2(1-x) +xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质分类和胶体的叙述.下列有关物质的分类说法正确的是
A.金属氧化物一定是碱性氧化物
B.胶体和其他分散系的本质区别是分散质粒子大小不同
C.生石灰、醋酸、纯碱、氯化钠对应的物质类别是氧化物、酸、碱、盐
D.酸性氧化物一定是非金属氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.5 mol/L的 NaOH溶液进行反应,从理论上说所求中和热不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量.下列表示氢氧化钠加入量(x)与溶液中沉淀的量(y)的关系示意图中正确的是( )
A.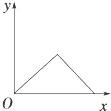
B.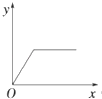
C.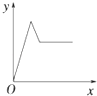
D.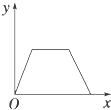
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由芳香烃X合成一种功能高分子H的过程如下。(部分产物、合成路线、反应条件略去)。
其中A是一氯代物,H的链节组成为C7H5NO
已知:I芳香烃X用质谱仪测出的质谱图如图所示
请根据所学知识与本题所给信息回答下列问题
(1)H的结构简式是_____________;(2)反应③和④的类型分别是_____________、_____________
(3)反应⑤的化学方程式是__________________________
(4)阿司匹林中含氧官能团的名称为__________________________
(5) 的一种同系物
的一种同系物 有多种同分异构体,其中符合下列要求的共有_____________种(不考虑立体异构),写出其中核磁共振氢谱为6组峰,且峰面积比为2:2:2:2:1:1的结构简式_____________
有多种同分异构体,其中符合下列要求的共有_____________种(不考虑立体异构),写出其中核磁共振氢谱为6组峰,且峰面积比为2:2:2:2:1:1的结构简式_____________
①能与 NaHCO3反应放出CO2
②能与FeCl3溶液发生显色反应
③苯环上的一取代物有两种
(6)请用合成反应流程图表示出由A和其他无机物合成 最合理的方案。_______________
最合理的方案。_______________
例:  。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐及SiO2杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是____________________(至少答两条)
(2)步骤Ⅱ中,加氨水调节溶液的pH为5.0~6.0,则滤渣1的成分主要为______(填化学式);已知MnO2的作用为氧化剂,“除杂1”中涉及的离子方程式为:NH3﹒H2O+H+==NH4+ +H2O、__________________、___________________。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是_______________________。
(4)滤液2中,c(Co2+) :c(Ni2+)=_______________。
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,假设滤渣1为含铁元素的纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为_________(用含a、b、c的式子表达,无需化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com