
【题目】萜类化合物具有重要的生理活性,是研究天然产物和开发新药的重要来源。 (c)、
(c)、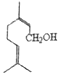 (n)、
(n)、 (t)均为常见萜类化合物,下列说法不正确的是
(t)均为常见萜类化合物,下列说法不正确的是
A. c、n互为同分异构体 B. n中所有碳原子可能处于同一平面
C. c、n、t均可以发生聚合反应 D. c、n、t均可使酸性KMnO4溶液褪色
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题: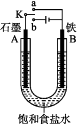
(1)若开始时开关K与a连接,则B极的电极反应为。
(2)若开始时开关K与b连接,则B极的电极反应为 , 总反应的离子方程式为。
(3)有关上述实验,下列说法正确的是。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。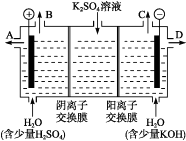
①该电解槽的阳极反应为。 此时通过阴离子交换膜的离子数(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时将a mol/L 氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是

A. a<1.0 B. 水的电离程度:b<d<c
C. C点:c(NH4+)=1.0mol/L D. d点:c(Cl-)<c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两种有机物,当混合物的质量一定时,无论A、B以任意比例混合,完全燃烧时产生的CO2的量均相等,则符合上述条件的是
①同分异构体②同系物③具有相同的最简式④含碳的质量分数相同。
A. ①③ B. ②④ C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)已知:①CO(g)+ ![]() O2(g)=CO2(g)△H=-283.0kJmol-1
O2(g)=CO2(g)△H=-283.0kJmol-1
②CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=-726.5kJmol-1
O2(g)=CO2(g)+2H2O(l)△H=-726.5kJmol-1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为2molN2时的△H= 。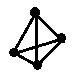
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用下图装置进行制取乙酸乙酯的实验。
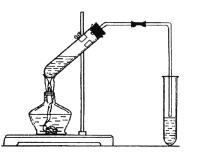
请回答下列问题:
(1)反应物中含有的官能团有____(填写名称)。
(2)实验室加入反应物和浓硫酸的先后顺序是____。
(3)浓硫酸在该反应中的作用是________。
(4)右边试管中的溶液是____,其作用是________。
(5)用同位素180示踪法确定反应原理(18O在CH3CH2OH中),写出能表示18O位置的化学方程式_______ ,反应类型是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土有工业“黄金”之称,我国稀土资源丰富。目前从氟碳铈矿(主要化学成分为CeFCO3)提取铈族稀土元素的冶炼处理工艺已经发展到十几种,其中一种提取铈的工艺流程如下:

已知:①焙烧后烧渣中含+4价的铈及+3价的其它稀土氟氧化物:
②Ce4+能与SO42-结合成CeSO4,Ce4+能被萃取剂[(HA)2]萃取。
请回答下列问题:
(1)CeFCO3中,Ce元素的化合价为_____。
(2)“酸浸I”过程中CeO2转化为Ce3+,且产生黄绿色气体,用稀硫酸和H2O2,替换HCl就不会造成环境污染。则稀硫酸.H2O2与CeO2反应的离子方程式为:__________。
(3)“沉淀”步骤中发生的反应为:Ce(BF4)3(s)+3KCl(aq)=3KBF4(s)+CeCl3(aq)。已知Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数为______(用含a、b的代数式表示)。
(4)“浸出液”中含有少量Ce4+及其他稀土元素的离子,可以通过“萃取”与“反萃取寻探作进一步分离、富集各离子。“萃取”时Ce4+与萃取剂[(HA)2]存在的反应为:Ce4++n(HA)2![]() Ce(H2a-4A2a)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2a-4A2a)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-),D随浸出液中c(SO42-)增大而减小的原因是__________。
)其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-),D随浸出液中c(SO42-)增大而减小的原因是__________。
(5)“操作I”后,向溶液中加入NaOH溶液,调节溶液的pH可获得Ce(OH)3沉淀,当溶液中离子浓度小于1.0×10-6mol/L视为沉淀完全,常温下加入NaOH调节溶液的pH应大于_______[已知:Ce(OH)3的Ksp=8.0×10-21;1g2=-0.3]
(6)写出“氧化”步骤的化学方程式:_______________。
(7)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧在尾气消除过程中发生着CeO2![]() CeO2(1-x) +xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:________________。
CeO2(1-x) +xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.5 mol/L的 NaOH溶液进行反应,从理论上说所求中和热不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过如下流程制备氧化亚铜:
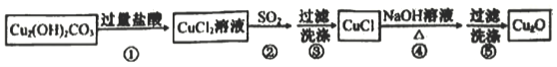
已知CuCl难溶于水和稀硫酸:Cu2O+2H+==Cu2++Cu+H2O
下列说法不正确的是
A. 步骤②SO2可用Na2SO3替换
B. 步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤
C. 步骤④发生反应的离子方程式为2CuCl+2OH-=Cu2O+2Cl-+H2O
D. 如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与Cu2O试样充分反应,根据反应前、后固体质量可计算试样纯度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com