
【题目】标准状况下,3.36L某气态烃A在足量O2中完全燃烧。若将产物通入足量澄清石灰水中,得到的白色沉淀质量30.0g;若用足量的碱石灰吸收燃烧产物,增重18.6g。则该烃的分子式为( )
A. C2H6 B. C3H8 C. C3H6 D. C2H4
科目:高中化学 来源: 题型:
【题目】用氧化还原滴定法测定某种草酸晶体(H2C2O4·X H2O)中结晶水分子数的实验步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液;
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,三次结果如下:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知:H2C2O4的相对分子质量为90。
回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在_____ (填“酸式”或“碱式”)滴定管中。
(2)H2C2O4在溶液中与KMnO4溶液反应的化学方程式是______________
(3)到达滴定终点的标志是____________。
(4)根据上述数据计算X=________________。
(5)误差分析(填:偏高、偏低、无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值_________;
②若滴定管水洗后直接加入KMnO4标准溶液,则X值_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是( )
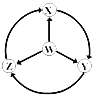 (选项中按 W X Y Z 的顺序)
(选项中按 W X Y Z 的顺序)
A. S SO2 SO3 H2SO4 B. Na Na2O2 NaOH NaCl
C. Fe FeCl3 Fe(OH)2 FeCl2 D. Al AlCl3 NaAlO2 Al2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①0.1mol/L硫酸②小苏打③纯碱④二氧化碳⑤葡萄糖⑥0.1mol/LNaOH溶液⑦SiO2 ⑧氨水⑨Al2O3⑩硫酸铁溶液
(1)上述十种物质中属于非电解质的有_____(填序号)。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,这两种物质的序号是______(填序号)。
(3)既能跟盐酸反应又能跟NaOH溶液反应的是_____(填序号)。
(4)标准状况下,_____L④中含有0.4mol氧原子。
(5)⑥与⑦溶液反应的离子方程式为__________。
(6)硅是信息技术的关键材料,写出工业上用⑦制备粗硅的化学反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(夹持仪器省略)进行实验,将液体A逐渐加入固体B中。回答下列问题:
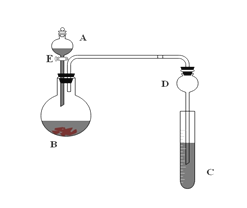
(1)图中D装置在实验中的作用____________________;
(2)若A中为浓盐酸,B中为高锰酸钾,C中盛有KI淀粉溶液,旋开E后,C中的现象是溶液变蓝色,试写出A与B反应的化学方程式_________________________:
(3)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E足够长的时间后,C中的现象是____________________,C中发生反应的化学方程式为:__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.9 g镁铝合金投入到500 mL 2 mol/L的硫酸中,合金完全溶解,再加入4 mol/L的NaOH溶液,若要生成的沉淀最多,加入NaOH溶液的体积是
A. 125 mL B. 200 mL C. 250 mL D. 500 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水三氯化铁呈棕红色,易潮解,100℃左右时升华,冷却后易凝华。下图是两名学生设计的用氯气与铁反应制备无水三氯化铁的实验装置。左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:

(1)A仪器的名称是_____________________;
(2)B中反应的离子方程式为______________________;其中浓盐酸表现出________性;若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于1.12 L(标准状况)的原因是______________。
(3)气体通过装置C的目的是________________。
(4)D中的反应开始前,需进行的操作是___________,应采取的方法是__________________。
(5)D中发生反应的化学方程式为__________________________________________。
(6)装置(Ⅰ)的主要缺点是_______________________________________________。
(7)装置(Ⅱ)中F中发生反应的化学方程式为___________________________。如果选用(Ⅱ)装置来完成实验,则必须采取的改进措施是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯丙醇异丁酸酯(![]() )是一种合成香料,其中一种合成路线如图:
)是一种合成香料,其中一种合成路线如图:

已知:R-CH=CH2![]() R-CH2CH2OH。请回答下列问题:
R-CH2CH2OH。请回答下列问题:
(1)A的化学名称是______________,B中含有的官能团名称是________________。
(2)在一定条件下,A与水反应也可以生成B或另外一种生成物,该反应的反应类型为___________,“另外一种生成物”的结构简式为_____________________________。
(3)C可被新制的Cu(OH)2悬浊液氧化,也可以被其他氧化剂所氧化。写出C与银氨溶液反应的化学方程式:_____________________________。
(4)D的核磁共振氢谱显示为6组峰,且峰面积之比为1∶1∶1∶1∶2∶2,则D的结构简式为_______________;D的同分异构体有多种,其中苯环上有两个不含环状的取代基,并能与Na反应的同分异构体有_______种(不含立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 标准状况下,22.4 L水中所含的分子数约为6.02×1023个
B. 1 mol Cl2中含有的原子数为NA
C. 标准状况下,a L氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023个
×6.02×1023个
D. 从1 L0.5 mol·L-1NaCl溶液中取出100 mL,剩余溶液中NaCl物质的量浓度为0.45 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com