
【题目】下列说法中正确的是
A. 标准状况下,22.4 L水中所含的分子数约为6.02×1023个
B. 1 mol Cl2中含有的原子数为NA
C. 标准状况下,a L氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023个
×6.02×1023个
D. 从1 L0.5 mol·L-1NaCl溶液中取出100 mL,剩余溶液中NaCl物质的量浓度为0.45 mol·L-1
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】标准状况下,3.36L某气态烃A在足量O2中完全燃烧。若将产物通入足量澄清石灰水中,得到的白色沉淀质量30.0g;若用足量的碱石灰吸收燃烧产物,增重18.6g。则该烃的分子式为( )
A. C2H6 B. C3H8 C. C3H6 D. C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,相同体积的两种气体A、B的质量比为22:17,若A气体为CO2,则B气体可能是
A. NH3 B. H2S C. SO2 D. O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下一定体积的HCl气体,将其溶于500mL的稀硫酸溶液中,假设溶液的体积不变化,向混合溶液中加入0.60mol/L的NaOH溶液50mL恰好呈中性。继续向呈中性的溶液中加入过量的氯化钡溶液,所的沉淀的质量为2.33g。
(1)生成沉淀的离子反应方程式:_______________________________。
(2)原硫酸溶液的浓度为:______________________________________。
(3)标准状况下HCl气体的体积为多少毫升?(写出计算过程)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为 ( )
A.![]() (a+b) mol B.(a-b) mol C.
(a+b) mol B.(a-b) mol C.![]() (a-b)mol D.(a+b) mol
(a-b)mol D.(a+b) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的的是
选项 | 实验方案 | 实验目的 |
A |
| 验证FeCl3对H2O2分解反应有催化作用 |
B |
将NO2球浸泡在冰水和热水中 | 探究温度对平衡2NO2 |
C |
| 除去CO2气体中混有的SO2 |
D |
| 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硝酸的尾气中含有氮氧化物NO、(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。工业上常用Na2CO3溶液吸收法处理NOx。
已知:NO不能与Na2CO3溶液反应
NO+NO2+Na2CO3=2NaNO2+CO2 (I)2NO2+Na2CO3=NaNO2+NaNO3+CO2 (II)
将lmolNOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3-、NO2-两种离子的物质的量随x变化关系如图所示。下列说法正确的是

A. 当NOx被Na2CO3溶液完全吸收时,x的值可能是1.3
B. 用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出) 时,吸收液质量就增加44g,则NOx中的x值为1.875
C. 图中线段a表示NO3-离子的物质的量随x值变化的关系
D. 若用溶质质量分数为21.2%的Na2CO3溶液吸收,则需要Na2CO3溶液至少150g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校研究性学习小组的同学进行了以下化学实验:将金属钙置于空气中燃烧,然后向所得固体产物中加入一定量蒸馏水,此过程中反应放出大量的热,并且放出有臭味的气体。
(1)甲同学提出:运用类比学习的思想,Ca与Mg位于同一主族,化学性质具有一定的相似性。请写出Ca在空气中燃烧发生反应的化学方程式_______________________________。
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧还应有CaO2生成,请写出燃烧后固体产物与水反应放出气体的化学方程式______________________________。丙同学提出用实验的方法探究放出臭味气体的成分:
(查阅资料)
1.CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3。
2.碘量法是最常用的臭氧测定方法,其原理为强氧化剂臭氧(O3)与碘化钾(KI)水溶液反应生成游离碘(I2),臭氧转化为氧气。反应式为O3+2KI+H2O===O2+I2+2KOH。
(提出假设)
假设1:该臭味气体只有NH3;
假设2:该臭味气体只有________;
假设3:该臭味气体含有________。
(设计方案 进行实验探究)
(3)该小组同学设计如下实验方案,并进行实验,验证上述假设。请完成相关的实验操作步骤、预期现象及结论(仪器自选)。
限选实验试剂:红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉-KI溶液、蒸馏水。
实验操作 | 预期现象与结论 |
取少量反应后固体于试管中,_____________ | ______________________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼的熔点为-107.3 ℃,沸点为12.5 ℃,易水解生成硼酸(H3BO3),可用于制造高纯硼、有机合成催化剂等。实验室制取三氯化硼的原理为B2O3+3C+3Cl2![]() 2BCl3+3CO。
2BCl3+3CO。
(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。

①装置B中盛放的试剂是__,装置C的作用是___________________。
②装置A中发生反应的离子方程式为 _____________________________。
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。
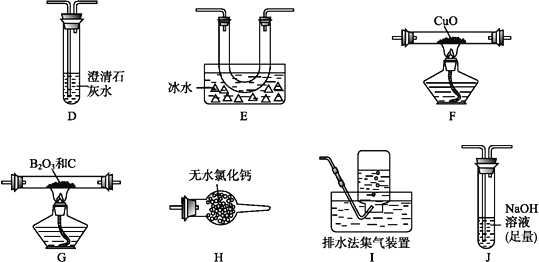
①乙组同学的实验装置中,依次连接的合理顺序为
A→B→C→G→__→__→__→__→F→D→I。
②能证明反应中有CO生成的现象是___________________________。
③开始实验时,先点燃____(填“A” 或“G”)处的酒精灯。
④请写出BCl3水解的化学方程式__________________________。
⑤硼酸是一元弱酸,其钠盐化学式为Na [B(OH)4],则硼酸在水中电离方程式是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com