
【题目】三氯化硼的熔点为-107.3 ℃,沸点为12.5 ℃,易水解生成硼酸(H3BO3),可用于制造高纯硼、有机合成催化剂等。实验室制取三氯化硼的原理为B2O3+3C+3Cl2![]() 2BCl3+3CO。
2BCl3+3CO。
(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。

①装置B中盛放的试剂是__,装置C的作用是___________________。
②装置A中发生反应的离子方程式为 _____________________________。
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。
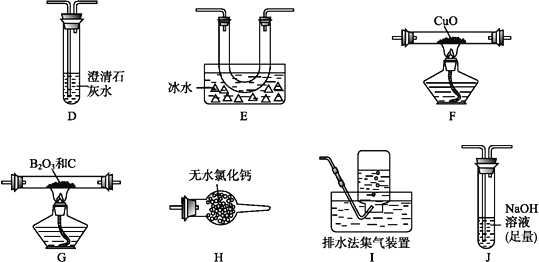
①乙组同学的实验装置中,依次连接的合理顺序为
A→B→C→G→__→__→__→__→F→D→I。
②能证明反应中有CO生成的现象是___________________________。
③开始实验时,先点燃____(填“A” 或“G”)处的酒精灯。
④请写出BCl3水解的化学方程式__________________________。
⑤硼酸是一元弱酸,其钠盐化学式为Na [B(OH)4],则硼酸在水中电离方程式是____。
【答案】 饱和食盐水 干燥氯气 2Mn+16H++10Cl-![]() 2Mn2++5Cl2↑+8H2O E H J H 装置F中黑色粉末变为红色,装置D中澄清石灰水变浑浊 A BCl3+3H2O=H3BO3+3HCl H3BO3+H2O
2Mn2++5Cl2↑+8H2O E H J H 装置F中黑色粉末变为红色,装置D中澄清石灰水变浑浊 A BCl3+3H2O=H3BO3+3HCl H3BO3+H2O![]() [B(OH)4〕-+H+
[B(OH)4〕-+H+
【解析】(1)根据实验装置图可知,用高锰酸钾与浓盐酸反应制得氯气,同时生成氯化钾和氯化锰,制得的氯气中含有氯化氢和水杂质,要用饱和食盐水除去氯化氢,用浓硫酸除去水份,而得到干燥纯净的氯气;
①根据上面的分析可知,装置B中盛放的试剂是饱和食盐水,装置C中装有浓硫酸,其作用是干燥氯气;
②装置A中高锰酸钾与浓盐酸反应制得氯气,同时生成氯化钾和氯化锰,发生反应的离子方程式为 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)乙组同学选用甲组实验中的装置A、B、C制得干燥的氯气,用氯气与B2O3、C反应生成三氯化硼和CO,三氯化硼的熔点为-107.3℃,沸点为12.5℃,所以收集三氯化硼要用冰水冷却,未反应的氯气尾气用氢氧化钠吸收,三氯化硼易水解,为防止氢氧化钠溶液中水进入装置E,在E和J之间接上H装置,用于吸水,生成的CO经干燥后再通过F装置还原氧化铜,再将生成的气体通过澄清石灰水检验,可以证明原反应中有一氧化碳生成,多余的CO不能排放到空气中,要用排水法收集;
①根据上面的分析可知,乙组同学的实验装置中,依次连接的合理顺序为A→B→C→G→E→H→J→H→F→D→I;
②根据实验的原理可知,生成的CO能将黑色的氧化铜还原为红色的铜,同时产生能使澄清石灰水变浑的气体,所以能证明反应中有CO生成的现象是装置F中黑色粉末变为红色,装置D中澄清石灰水变浑浊,;
③加热CuO前需要利用CO除去装置内空气,则开始实验时,先点燃A处的酒精灯;
④BCl3水解生成硼酸和氯化氢的化学方程式为BCl3+3H2O=H3BO3+3HCl;
⑤根据硼酸是一元弱酸,且其钠盐化学式为Na [B(OH)4],可知硼酸在水中电离方程式是H3BO3+H2O![]() [B(OH)4〕-+H+。
[B(OH)4〕-+H+。


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某有机物结构简式为 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A. 1 mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应
B. 该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C. 该有机物遇硝酸银溶液产生白色沉淀
D. 该有机物在一定条件下能发生消去反应或取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(13分)由乙烯和其它无机原料合成环状酯E和高分子化合物H的示意图如下:

请回答下列问题:
(1)写出结构简式:A F C
(2)反应类型:X 、Y
(3)写出化学反应方程式:
A→B
G→H
(4)若环状酯E在NaOH溶液中共热,则发生反应的化学方程式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3 物质结构与性质】
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z2+基态核外电子排布式为: 。
(2)YX4-的空间构型是:__________;与YX4-互为等电子体的一种分子为__________(填化学式);HYX4酸性比HYX2强,其原因是:__________________________。
(3)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为: ;1molRX(WH2)2分子中含有σ键数目为:_______________。(H为氢元素,下同)
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是:__________。
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如右图所示(黑点代表Z原子)。

①该晶体的化学式为: 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于 (填“离子”、“共价”)化合物。
③ 已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为: cm(只写计算式)(Z原子位于体对角线上)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 温度、浓度、压强、催化剂均能改变平衡常数
B. 升高温度,平衡常数一定增大
C. 平衡常数变化,化学平衡不一定发生移动
D. 化学平衡发生移动,平衡常数不一定改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4g NaOH固体配成250mL溶液,则Na+的物质的量浓度(mol/L)为
A. 0.0004 B. 0.016 C. 0.4 D. 16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。某种手机电路板中含有以下金属:Sn、Pb、Fe、Cu、Au、Ag、Ni(镍,银白色)、Pd (钯,银白色)。如图是某工厂回收其中部分金属的流程图.(假设流程图中各反应均恰好完全反应.己知:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O)
2CuSO4+2H2O)

(1)步骤②中产生的气体是________(写化学式)。
(2)滤渣2中含有的金属是________
(3)步骤⑤反应的化学方程式________。
(4)步骤⑥回收的纯净物B是________ (写化学式).
(5) 金属Fe、Ni、Pd在溶液中的活动性由强到弱的顺序依次是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把7.4 g Na2CO3·10H2O和NaHCO3组成的混合物溶于水,配成100 mL溶液,其中c(Na+)=0.6 mol·L-1。若把等质量的混合物加热到恒重时,残留物的质量是( )
A. 2.21 g B. 5.28 g C. 4.22 g D. 3.18 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com