
����Ŀ�������£����и���������ָ����Һ��һ���ܴ����������(����)
A. 1.0 mol��L��1 KNO3��Һ��H����Fe2����SCN����SO42��
B. c(H��)/c (OH��)��10��10����ɫ��Һ��Na ����Ba2����NO3����Cl��
C. ��ˮ�������c(H��)��10��10mol��L��1����Һ��![]() ��AlO2����Ca2����S2��
��AlO2����Ca2����S2��
D. c(ClO��)��1.0 mol��L��1����Һ��K����SO32����S2����SO42��
���𰸡�B
��������
A��1.0molL-1KNO3��Һ�д��ڴ�����������ӣ�����������ڴ���H+�����������ܹ�����Fe2+���ӣ�����Һ�в��ܴ������棬��A���� B�����ݳ�����ˮ�����ӻ�����֪��������Һ������������Ũ��Ϊ0.01mol/L��Na+��Ba2+��NO3-��Cl-����֮�䲻������Ӧ���Ҷ��������������ӷ�Ӧ������Һ���ܹ��������棬��B��ȷ��C����ˮ�������c��H+��=10-10mol/L����Һ�д��ڴ���H+��OH-��NH4+��Ca2+�������������ӷ�Ӧ��S2-��AlO2-���������ӷ�Ӧ��Ca2+��S2-��Ӧ������Һ��һ�����ܴ������棬��C����D����Һ��ClO-�ܹ�����SO32-��S2-������Һ�в��ܴ������棬��D����ѡB��


 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£�������ͬ��CO2��O2��CH4�������壬����˵���������
A. ��ռ������ɴ�С��˳���ǣ�CH4��O2��CO2
B. �����������ɶൽ�ٵ�˳���ǣ�CH4��O2��CO2
C. �ܶ��ɴ�С��˳���ǣ�CO2��O2��CH4
D. �����ĵ������ɶൽ���ǣ�CO2��CH4��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С������֤CO2��Na2O2��Ӧ�IJ�����������ʵ��װ�ý���ʵ�飺

��1��д��װ��A�з�Ӧ�Ļ�ѧ����ʽ________��
��2��д��װ��B�з�Ӧ�Ļ�ѧ����ʽ________��
��3������װ��D�ռ��������뽫װ�ò�������________��
��4��������飺�����������ķ���________��
��5������������ķ�������Bװ����ȡ�������壬����ˮ�����Һ��________��
��6����ͬѧ��Ϊ��ʵ��װ�ô�������ȱ�ݣ�����Ϊ��ȱ����ʲô________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ʵ��װ��ͼ��ȷ���ܴﵽ��Ӧʵ��Ŀ�ĵ���
A. װ�ó�ȥCl2�е�HCl 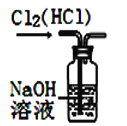
B. װ��ʵ������NH3 
C. װ�÷���MnO2��KCl 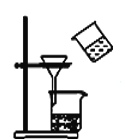
D. װ������NH4Cl������Һ�Ʊ�NH4Cl����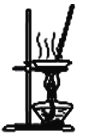
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ȼ�γɵ�����Ĥ�����䡣������Ϊ���Һ���ֱ���ʯī�������������������ϣ����������γ�������Ĥ����ʴ����ǿ�����Ʊ��ļ�Ҫ������ͼ��ʾ�������������������з�Ӧ�ķ���ʽ����ȷ����
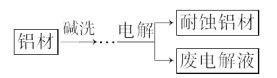
A. ��ϴĿ���dz�ȥ���ı������Ȼ����Ĥ��2OH����Al2O3===2AlO2-��H2O
B. ��ϴʱ���ı����������ݣ�2Al��2OH����2H2O===2AlO2-��3H2��
C. �����ʴ���ĵĵ缫��Ӧ��4Al��12e����3O2===2Al2O3
D. ��ϡ��ˮϴȥ��ʴ���ı�����NH3��H2O��H��===NH4+��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�pH=1��ij��ҺA�к���NH4+��K+��Na+��Fe3+��Al3+��Fe2+��CO32-��NO3-��Cl-��I-��SO42���е�4�֣�����Һ�������ӵ����ʵ���Ũ�Ⱦ�Ϊ0.1mol/L����ȡ����Һ�����й�ʵ�飬ʵ��������ͼ��ʾ�� �����й�˵����ȷ����
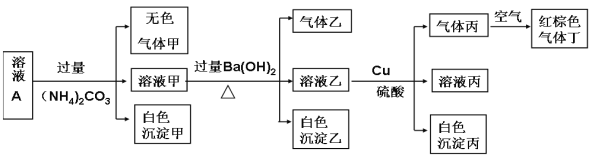
A������Һ��һ�������������е�NO3-��Al3+��SO42����Cl-��������
B��ʵ������Cu 14.4g,���������嶡�����Ϊ3.36L
C��������һ����BaCO3��������BaSO4
D��һ��û��Fe3+��������ȷ���Ƿ���I-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ����ѡ���װ�û�����(�г�װ������ȥ)��ȷ����(����)
|
|
A.��CCl4��ȡ��ˮ�е�Br2 | B.��KI��I2�Ĺ��������л���I2 |
|
|
C.ϡ��Ũ���� | D.��ҵ�ƾ��Ʊ���ˮ�ƾ� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����õ�ⱥ��ʳ��ˮ��������(Cl2)���ռ�������Ļ�ѧ����ʽ��:2NaCl + 2H2O![]() NaOH + Cl2��+ H2��
NaOH + Cl2��+ H2��
(1)��˫���ű�ʾ������ת�Ƶķ������Ŀ______________����з�Ӧ��д�����ӷ���ʽ��___________________________________
(2)���ʳ��ˮ�Ĺ����У�����������__________________________________
(3)���ʳ��ˮҪ��Դ�ʳ��ˮ���о��ƣ��Գ�ȥ��ʳ��ˮ�к��е���ɳ��SO42-��Ca2+,Mg2+���������ӡ�����ʱ���μ����Ȼ�����Һ������ռ��ַ�Ӧ����ˣ�����Һ�м��������к������ԡ���������Һ��Ӧ�����ӷ���ʽ:___________________,________________________________.
(4)ʵ�������ù���NaOH������90ml 0.5 mol/L��NaOH��Һ���������ϳ��ӣ���Ҫ��������NaOH_______g������ʱ��һ��ɷ�Ϊ���¼������裺�ٳ��� �ڼ��� ���ܽ� ��ҡ�� ��ת�� ��ϴ�� �߶��� ����ȴ������ȷ�IJ���˳��Ϊ__________�������ƹ����У���������������ȷ�����в�����������ƫ�͵���___________(����ĸ)��
A��û��ϴ���ձ��Ͳ�����
B��δ��NaOH��Һ��ȴ�����¾�ת�Ƶ�����ƿ�ж���
C������ƿ�����������������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
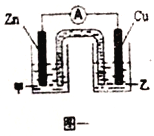
����Ŀ��CuSO4��Һ����ѧ��ѧ��ũҵ�����г�����һ���Լ���
��1��ijͬѧ����CuSO4��Һʱ�������һ������������Һ�������ӷ���ʽ˵����ԭ����____________��
��2����ͬѧ�����Ƶõ�CuSO4��Һ����������ʵ��̽����
��ͼһ�Ǹ��ݷ�ӦZn+CuSO4=Cu+ZnSO4��Ƴɵ�пͭԭ��ء��������Һ����_______(����ZnSO4������CuSO4��)��Һ;Cu���ĵ�巴Ӧʽ��_______��
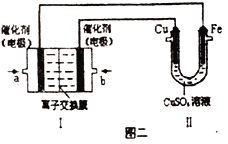
��ͼ���У����Ǽ���ȼ�ϵ��(�������ҺΪKOH��Һ)�Ľṹʾ��ͼ����ͬѧ��������ʵ�����϶�ͭ����a��ͨ�����_______(����CH4������O2��)��a���缫�Ϸ����ĵ缫��Ӧʽ��_____________����ֻ�����е缫����Ϊ���Ե缫�����ʱ�Ļ�ѧ��Ӧ����ʽΪ_____________________���������е缫����Ϊ���Ե缫�����Һ��Ϊ����0.04molCuSO4��0.04molNaCl�Ļ����Һ400mL������������������Ϊ672mL(��״����)ʱ����Һ��pH=_______(���������Һ�������)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com