
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如下图所示: 下列有关说法正确的是
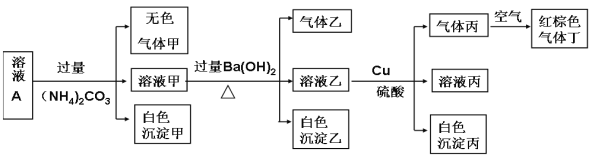
A.该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B.实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
C.沉淀乙一定有BaCO3,可能有BaSO4
D.一定没有Fe3+,但是无法确定是否含有I-
【答案】A
【解析】
试题分析:pH=1,说明溶液显强酸性,说明有H+,CO32-一定不存在,A、溶液A中加入过量的(NH4)2CO3溶液,Fe3+和CO32-发生双水解,生成氢氧化铁沉淀(红褐色),说明原溶液中不含Fe3+,但溶液乙中加入Cu和硫酸,产生气体丙,气体丙遇空气变成红棕色气体丁因此,丁为NO2,丙为:NO,说明原溶液中有NO3-,但是NO3-在酸性条件下具有氧化性,因为Fe2+、I-具有还原性,因此不能大量存在,因此白色沉淀甲为Al(OH)3,原溶液中含有Al3+,根据溶液显电中性,阳离子所带的电荷数总物质的量浓度为3n(Al3+)+n(H+)=3×0.1+0.1=0.4mol·L-1,而NO3-所带电荷数为0.1mol·L-1,又因为各离子浓度为0.1mol·L-1,因此原溶液中含有SO42-、Cl-,故正确;B、题目中没有说标准状况,因此无法计算气体体积,故错误;C、因为加的是过量的(NH4)2CO3,所以有Ba2++CO32-=BaCO3↓,根据A选项的分析,原溶液中有SO42-,因此也就有Ba2++SO42-=BaSO4↓,因此沉淀乙一定是BaCO3、BaSO4,故错误;D、根据A选项的分析,原溶液中一定没有I-,故错误。


科目:高中化学 来源: 题型:
【题目】以铝土矿为原料,提取氧化铝,冶炼铝的工艺流程如下,下列说法错误的是
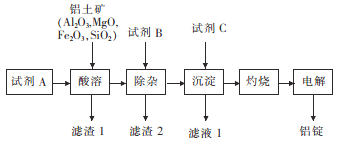
已知:滤渣2主要成分是氢氧化铁、氢氧化镁,B的焰色呈黄色。
A. 试剂A可以是稀硫酸或盐酸 B. 加入试剂B除去Mg2+、Fe3+
C. 滤渣1主要成分是SiO2 D. 电解氧化铝时在阴极上定期补炭块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 向新制氯水中加入少量CaCO3粉末后,溶液的pH减小
B. SO2、氯气都能使品红溶液褪色,但原理不同
C. NaHCO3、CH3COONH4都能分别和盐酸、烧碱溶液反应
D. FeSO4溶液、Na2SO3溶液在空气中都易因氧化而变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、SO42-
B. c(H+)/c (OH-)=10-10的无色溶液:Na +、Ba2+、NO3-、Cl-
C. 由水电离产生c(H+)=10-10mol·L-1的溶液:![]() 、AlO2-、Ca2+、S2-
、AlO2-、Ca2+、S2-
D. c(ClO-)=1.0 mol·L-1的溶液:K+、SO32-、S2-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是( )

A. 图A中测定锌粒与1 mol/L稀硫酸反应速率,只需测定注射器中收集氢气的体积
B. 图B装置中进行50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液测定中和热,使温度计温度升高的热量就是中和反应生成1 mol水的热量
C. 图C酸碱中和滴定中,可以在滴定过程中用少量水冲洗锥形瓶内壁以减小实验误差
D. 图D滴定管中读数为26.50mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试剂瓶上贴有如下标签,对该试剂理解正确的是
![]()
A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0mol/LNa2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A. CO32-的水解方程式:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
C. 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
D. AlCl3溶液与Na2CO3溶液混合:2Al3++3CO32-=Al2(CO3)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
(1)工业上的湿法制备方法是用KClO 与Fe(OH)3在KOH 存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为_____________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:

①操作(Ⅰ)的方法为在隔绝空气条件下________、________、过滤、洗涤、隔绝空气减压干燥。
②写出产生X气体的化学方程式_______________________________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液;
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中;
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-;
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+;
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)溶液的体积,做3次平行实验,平均消耗30.00mL的(NH4)2Fe(SO4)2溶液。
已知:K2Cr2O7水溶液显黄色,滴定时发生的反应为:6Fe2++Cr2O72-+14H+==6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mLK2FeO4溶液加入到锥形瓶中所用的仪器是________。
②写出步骤3中发生反应的例子方程式___________________________________。
③根据上述实验数据,测定该样品中K2FeO4的质量分数为___________。(K2FeO4摩尔质量为198g/mol)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com