
【题目】(题文)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
(1)工业上的湿法制备方法是用KClO 与Fe(OH)3在KOH 存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为_____________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:

①操作(Ⅰ)的方法为在隔绝空气条件下________、________、过滤、洗涤、隔绝空气减压干燥。
②写出产生X气体的化学方程式_______________________________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液;
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中;
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-;
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+;
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)溶液的体积,做3次平行实验,平均消耗30.00mL的(NH4)2Fe(SO4)2溶液。
已知:K2Cr2O7水溶液显黄色,滴定时发生的反应为:6Fe2++Cr2O72-+14H+==6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mLK2FeO4溶液加入到锥形瓶中所用的仪器是________。
②写出步骤3中发生反应的例子方程式___________________________________。
③根据上述实验数据,测定该样品中K2FeO4的质量分数为___________。(K2FeO4摩尔质量为198g/mol)。
【答案】3:2蒸发浓缩冷却结晶2Na2O2=2Na2O+O2酸式滴定管CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH-79.2%
【解析】
(1)湿法制备高铁酸钾(K2FeO4),则FeO42-为产物,Fe(OH)3为反应物,化合价升高总共3价,由电子转移守恒可知,ClO-为反应物,Cl-为生成物,化合价降低共2将,化合价升降最小公倍数为6,故Fe(OH)3的系数为2,FeO42-的系数为2,ClO-的系数为3,Cl-的系数为3,根据电荷守恒可知,OH-为反应物,系数为4,由元素守恒可知H2O为生成物,其系数为5,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,该反应氧化剂与还原剂物质的量之比为3:2;(2)①操作(I)是溶液中得到硫酸亚铁晶体的方法为:蒸发浓缩、冷却结晶、过滤、洗涤、隔绝空气减压干燥;②过程分析可知X为氧气,根据流程可知由过氧化钠分解而得,反应的化学方程式为2Na2O2=2Na2O+O2;(3)①K2FeO4溶液具有强氧化性,准确量取25.00mL K2FeO4溶液加入到锥形瓶中应在酸式滴定管中量取;
②在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-,铬元素化合价+3价变化为+6价,铁元素+6价变化为+3价,结合电子守恒和电荷守恒配平得到离子方程式为:CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH-;③CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH-;6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,得到定量关系为:
2FeO42-~2CrO42-~Cr2O72-~6Fe2+,
2 6
n 0.0300L×0.1000mol/L
n=0.001mol,
100mL溶液中含有0.001mol×![]() =0.004mol,
=0.004mol,
测定该样品中K2FeO4的质量分数=![]() ×100%=79.2%。
×100%=79.2%。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如下图所示: 下列有关说法正确的是
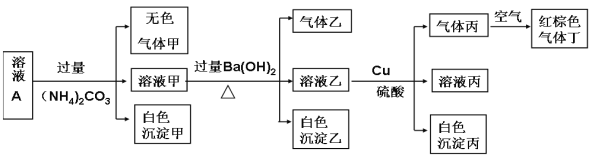
A.该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B.实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
C.沉淀乙一定有BaCO3,可能有BaSO4
D.一定没有Fe3+,但是无法确定是否含有I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在能源和材料方面具有广泛的用途,回答下列问题:
(1)已知CH4(g)+![]() O2(g)=CO(g)+2H2O(l)
O2(g)=CO(g)+2H2O(l) ![]() =-607.31kJ/mol
=-607.31kJ/mol
2CO(g)+ O2(g)=2CO2(g) ![]() =-566.0kJ/mol
=-566.0kJ/mol
写出表示甲烷燃烧热的热化学方程式________________。
(2)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 。
2CO(g)+2H2(g) 。
在密闭容器中通入物质的量浓度均为0.1mol/L的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示。则:
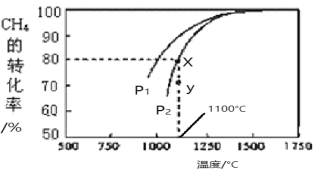
①压强P2_____P1(填 “>”或“<”);原因________________________________________________________________________________。
②压强为P1时,在Y点:v(逆)_______v(正)(填“>”、“<”或“=”)。
③求X点对应温度下的该反应的平衡常数K=____________。(计算结果保留两位小数)
(3)CO可以合成二甲醚,CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H<0,二甲醚可以作为燃料电池的原料。利用此燃料电池以石墨为电极电解1L,0.5mol/L的CuSO4溶液,导线通过0.1mol电子时,假设溶液体积不变,则所得溶液pH=______________,标况下理论上产生O2_______________L(保留小数点后两位)。
CH3OCH3(g)+H2O(g) △H<0,二甲醚可以作为燃料电池的原料。利用此燃料电池以石墨为电极电解1L,0.5mol/L的CuSO4溶液,导线通过0.1mol电子时,假设溶液体积不变,则所得溶液pH=______________,标况下理论上产生O2_______________L(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图甲所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图乙所示。则下列分析正确的是( )
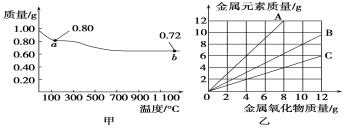
A. 图甲中a点和b点对应物质的化学式分别为Cu2O和CuO
B. 图甲整个过程中共生成0.26 g水
C. 图乙三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A
D. 图甲中,a到b的过程中有0.01 mol电子发生了转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液是中学化学及农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是____________。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
①图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。电解质溶液乙是_______(填“ZnSO4”或“CuSO4”)溶液;Cu极的电板反应式是_______。
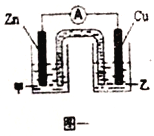
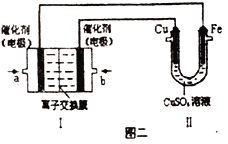
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则a处通入的是_______(填“CH4”或“O2”),a处电极上发生的电极反应式是_____________。若只把Ⅱ中电极均换为惰性电极,电解时的化学反应方程式为_____________________。若把Ⅱ中电极均换为惰性电极,电解液换为含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生的气体为672mL(标准状况下)时,溶液的pH=_______(假设电解后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图中四个图像的说法正确的是
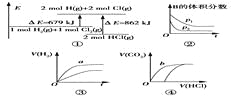
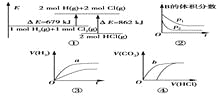
注:图中,E表示能量,p表示压强,t表示时间,V表示体积。
A. ①表示化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化,则该反应的反应热ΔH=+183 kJ/mol
B. ②表示其他条件不变时,反应4A(g)+3B(g)![]() 2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体
2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体
C. ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液
D. ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-空气电池原理模型如图所示,下列说法不正确的是

A. 电池正极可以吸附空气中氧气作为氧化剂
B. 正极反应为2Li+ + O2 + 2e- ![]() Li2O2
Li2O2
C. 电解质能传递锂离子和电子,不可以用水溶液
D. 负极反应Li - e-=Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有失去标签的甲、乙、丙、丁四瓶溶液,它们分別是Ba(NO3)2、H2SO4、Na2SO4、K2CO3的一种,为了鉴别他们,进行了如下实验:
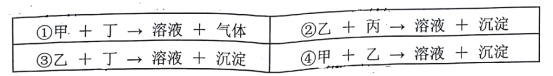
在④得到的沉淀中加入足量稀盐酸,沉淀迅速溶解,并产生无色无味的气体。
根据以上实验事实,回答下列问题:
(1)从④得到沉淀所使用的玻璃仪器有__________________________。
(2)乙、丁的名称分别是:乙_______________,丁_____________。
(3)请写出在④得到的沉淀中加入足量稀盐酸的离子反应方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com