
【题目】关于如图中四个图像的说法正确的是
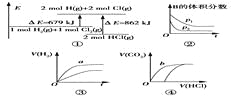
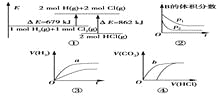
注:图中,E表示能量,p表示压强,t表示时间,V表示体积。
A. ①表示化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化,则该反应的反应热ΔH=+183 kJ/mol
B. ②表示其他条件不变时,反应4A(g)+3B(g)![]() 2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体
2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体
C. ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液
D. ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液
科目:高中化学 来源: 题型:
【题目】某试剂瓶上贴有如下标签,对该试剂理解正确的是
![]()
A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0mol/LNa2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:
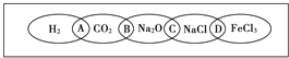
(1)请将分类依据代号填入相应的括号内:
(________)两种物质都不是电解质
(________)两种物质都是钠的化合物
(________)两种物质都是氧化物
(________)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入上图中某种物质M的饱和溶液,继续煮沸至溶液呈红褐色.
①物质M的化学式为____________。
②证明有红褐色胶体生成的实验操作是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
(1)工业上的湿法制备方法是用KClO 与Fe(OH)3在KOH 存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为_____________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:

①操作(Ⅰ)的方法为在隔绝空气条件下________、________、过滤、洗涤、隔绝空气减压干燥。
②写出产生X气体的化学方程式_______________________________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液;
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中;
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-;
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+;
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)溶液的体积,做3次平行实验,平均消耗30.00mL的(NH4)2Fe(SO4)2溶液。
已知:K2Cr2O7水溶液显黄色,滴定时发生的反应为:6Fe2++Cr2O72-+14H+==6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mLK2FeO4溶液加入到锥形瓶中所用的仪器是________。
②写出步骤3中发生反应的例子方程式___________________________________。
③根据上述实验数据,测定该样品中K2FeO4的质量分数为___________。(K2FeO4摩尔质量为198g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是
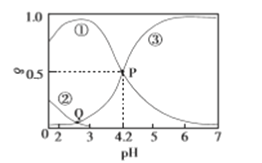
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. Q点对应的溶液中lgc(H+)<lgc(OH-)
C. 20℃时,H2C2O4的一级电离平衡常数Ka1=1×10-4.2
D. 0.100mol/L的NaHC2O4溶液中:c(OH-)=c(H+)- c(C2O42-)+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作与说法正确的是( )

A. 实验室制乙烯
B. 实验室制乙炔并验证乙炔能发生氧化反应
C. 实验室中分馏石油
D. 若甲为醋酸,乙为贝壳(粉状),丙为苯酚钠溶液,则该装置不可以验证醋酸、碳酸、苯酚酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的污水中可能含有NH4+、Fe2+、Cl-、Fe3+、SO42-、HCO3-离子中的一种或几种,为检验上述离子,某兴趣小组设计了如下实验方案, 下列说法正确的是

A. 沉淀l为BaCO3和BaSO4
B. 沉淀2可能为AgCl和Ag2SO4
C. 该污水中一定存在Fe3+,不存在Fe2+
D. 该污水中一定存在NH4+、Cl-、Fe3+、SO42-离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] 有关物质性质
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇, 两性化合物 | 易溶于水和乙醇,有强酸性 和还原性 | 易溶于水, 难溶于乙醇 |
实验过程:Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:将配制好的绿矾溶液与200mL 1.1mol·L-1NH4HCO3溶液混合,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。回答下列问题:

(1)实验I中:实验室配制绿矾溶液,将铁粉与稀硫酸混合时哪种试剂应该过量_______
(2)实验II中:制备FeCO3时应向_______溶液中缓慢加入________溶液边加边搅拌,若颠倒试剂滴加顺序可能产生的后果是__________________生成沉淀的离子方程式为________________
(3)确认C中空气排尽的实验现象是______________
(4)加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是___________
(5)洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是___________________。(填序号)
A.热水 B.乙醇溶液 C.柠檬酸溶液
(6)若产品的质量为17.34g,则产率为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用MnO2 和浓盐酸反应制Cl2,当有0.4molHCl被氧化时,生成的Cl2全部用石灰水吸收,则计算:
(1)制Cl2的反应中转移电子的数目?
(2)生成Cl2的体积(标准状况下)?
(3)制得漂白粉[CaCl2和Ca( ClO)2的混合物]的质量? (写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com