
【题目】用MnO2 和浓盐酸反应制Cl2,当有0.4molHCl被氧化时,生成的Cl2全部用石灰水吸收,则计算:
(1)制Cl2的反应中转移电子的数目?
(2)生成Cl2的体积(标准状况下)?
(3)制得漂白粉[CaCl2和Ca( ClO)2的混合物]的质量? (写出计算过程)
【答案】(1)0.4NA(2)4.48L (3)25.4g
【解析】
发生的方程式有:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,根据反应的方程式计算。
MnCl2+Cl2↑+2H2O,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,根据反应的方程式计算。
(1)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,当有0.4molHCl被氧化时,反应转移了0.4mol电子,则转移电子数为0.4NA;
MnCl2+Cl2↑+2H2O,当有0.4molHCl被氧化时,反应转移了0.4mol电子,则转移电子数为0.4NA;
(2)在MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O反应中,当有0.4molHCl被氧化时,生成氯气0.2mol;气体的体积为0.2mol ×22.4L/mol=4.48L;
MnCl2+Cl2↑+2H2O反应中,当有0.4molHCl被氧化时,生成氯气0.2mol;气体的体积为0.2mol ×22.4L/mol=4.48L;
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2mol 111g 143g
0.2mol 11.1g 14.3g
则所得漂白粉的质量为11.1g+14.3g=25.4g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于如图中四个图像的说法正确的是
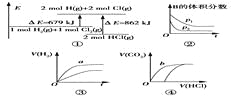
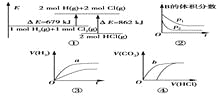
注:图中,E表示能量,p表示压强,t表示时间,V表示体积。
A. ①表示化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化,则该反应的反应热ΔH=+183 kJ/mol
B. ②表示其他条件不变时,反应4A(g)+3B(g)![]() 2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体
2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体
C. ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液
D. ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述不正确的是
A. 标准状况下,分子数为NA的CO2、N2O混合气体体积约为22.4L,质量为44克
B. 常温常压下,16gO2所含的原子数为NA
C. 由O2和NO2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D. 标准状况下,22.4LH2O所合的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有失去标签的甲、乙、丙、丁四瓶溶液,它们分別是Ba(NO3)2、H2SO4、Na2SO4、K2CO3的一种,为了鉴别他们,进行了如下实验:
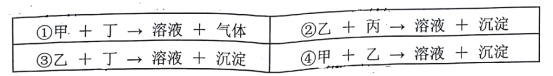
在④得到的沉淀中加入足量稀盐酸,沉淀迅速溶解,并产生无色无味的气体。
根据以上实验事实,回答下列问题:
(1)从④得到沉淀所使用的玻璃仪器有__________________________。
(2)乙、丁的名称分别是:乙_______________,丁_____________。
(3)请写出在④得到的沉淀中加入足量稀盐酸的离子反应方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,某研究性学习小组用下图装置进行“草酸晶体受热分解的部分产物的验证”的实验。请回答下列问题。

【资料查阅】
①草酸晶体在101 ℃时开始熔化,150 ℃时开始升华,175 ℃时开始分解;
②草酸钙和草酸氢钙均为白色不溶物。
(1)按照如图所示的装置,通过实验检验草酸晶体的部分分解产物,装置B中可观察到有气泡冒出且澄清石灰水变浑浊,由此甲同学判断草酸晶体分解的产物中有CO2。但立即遭到乙同学反对,其反对的理由可能是______________________________________。
(2)丙同学认为草酸晶体分解的产物中含有CO,为进行验证,X应选用________(填化学式)浓溶液,装置D的作用是____________________。
(3)实验过程中涉及如下操作:①点燃装置A处的酒精灯;②熄灭装置A处的酒精灯;③点燃装置E处的酒精灯;④熄灭装置E处的酒精灯。这4步操作由先到后的顺序为____________(填序号)。点燃E处酒精灯前必须要进行的操作是______________。
(4)实验过程中发现装置E中黑色粉末变红色,装置F中有黑色固体生成,经检测装置F中的固体为金属单质,则装置F中发生反应的化学方程式为________________________________________________________________________。
(5)丁同学用滴定法测定草酸晶体中结晶水的含量,进行了下列操作:
步骤一:用分析天平称取3.15 g纯净的该草酸晶体,配制成250 mL溶液。
步骤二:用移液管移取25.00 mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化。
步骤三:取0.100 mol·L-1标准酸性KMnO4溶液,进行滴定,三次结果如下表所示:
第一次 | 第二次 | 第三次 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知滴定反应的离子方程式为:MnO![]() +H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
①配制草酸溶液的操作步骤依次是:将晶体置于烧杯中,加水溶解,将溶液转移入________,洗涤,定容,摇匀。
②通过计算确定x=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不发生化学反应)的关系不正确的是
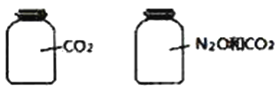
A. 所含氧原子数相等 B. 气体的总质量相等
C. 气体所含电子总数相等 D. 气体的密度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置:

(1)取ag合金粉末放入蒸馏烧瓶,并加入足量浓硫酸,A、B中均无明显现象,原因是________________________________________________。
(2)反应一段时间后,B中的现象为___________________________。
(3)装置C的作用是________________;装置D的作用是___________,F的作用是___________________________________________。
(4)反应结束后,若U形管E增重m g,则合金中碳的质量分数为________。(用含m和a的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,氧化剂和还原剂物质的量之比为1:4
MnCl2+Cl2↑+2H2O中,氧化剂和还原剂物质的量之比为1:4
B. KClO3+6HCl=KCl+3Cl2↑+2H2O,氧化剂和还原剂物质的量之比为1:5
C. 2H2S+SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为1:1
D. 3S+6KOH=2K2S+K2SO3+3H2O中被氧化和被还原的硫元素物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应的是 ( )
A. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
B. 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
C. FeO+2HCl=FeCl2+H2O
D. CuCl2+2NaOH=Cu(OH)2↓+2NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com