
����Ŀ�����ᾧ�����ɿɱ�ʾΪH2C2O4��xH2O��ij�о���ѧϰС������ͼװ�ý��������ᾧ�����ȷֽ�IJ��ֲ������֤����ʵ�顣��ش��������⡣

�����ϲ��ġ�
�����ᾧ����101 ��ʱ��ʼ�ۻ���150 ��ʱ��ʼ������175 ��ʱ��ʼ�ֽ⣻
������ƺͲ�����ƾ�Ϊ��ɫ�����
��1��������ͼ��ʾ��װ����ͨ��ʵ�������ᾧ��IJ��ַֽ������װ��B�пɹ۲쵽������ð���ҳ���ʯ��ˮ��������ɴ˼�ͬѧ�жϲ��ᾧ��ֽ�IJ�������CO2�����������ͬѧ�������䷴�Ե����ɿ�����______________________________________��
��2����ͬѧ��Ϊ���ᾧ��ֽ�IJ����к���CO��Ϊ������֤��XӦѡ��________(�ѧʽ)Ũ��Һ��װ��D��������____________________��
��3��ʵ��������漰���²������ٵ�ȼװ��A���ľƾ��ƣ���Ϩ��װ��A���ľƾ��ƣ��۵�ȼװ��E���ľƾ��ƣ���Ϩ��װ��E���ľƾ��ơ���4���������ȵ����˳��Ϊ____________(�����)����ȼE���ƾ���ǰ����Ҫ���еIJ�����______________��
��4��ʵ������з���װ��E�к�ɫ��ĩ���ɫ��װ��F���к�ɫ���������������װ��F�еĹ���Ϊ������������װ��F�з�����Ӧ�Ļ�ѧ����ʽΪ________________________________________________________________________��
��5����ͬѧ�õζ����ⶨ���ᾧ���нᾧˮ�ĺ��������������в�����
����һ���÷�����ƽ��ȡ3.15 g�����ĸò��ᾧ�������Ƴ�250 mL��Һ��
�����������Һ����ȡ25.00 mL���������Һ����ƿ�������������������ữ��
��������ȡ0.100 mol��L��1������KMnO4��Һ�����еζ������ν�����±���ʾ��
��һ�� | �ڶ��� | ������ | |
������Һ���(mL) | 25.00 | 25.00 | 25.00 |
����Һ���(mL) | 9.99 | 10.01 | 10.00 |
��֪�ζ���Ӧ�����ӷ���ʽΪ��MnO![]() ��H2C2O4��H���D��Mn2����CO2����H2O(δ��ƽ)��
��H2C2O4��H���D��Mn2����CO2����H2O(δ��ƽ)��
�����Ʋ�����Һ�IJ������������ǣ������������ձ�������ˮ�ܽ�������Һת����________��ϴ�ӣ����ݣ�ҡ�ȡ�
��ͨ������ȷ��x��________��
���𰸡� �ӷ����IJ��������ʯ��ˮ��ӦҲ������ͬ������(����Ϊ����ơ�������ƶ�Ϊ��ɫ����) NaOH ����CO(���ȥCO�е�ˮ����) �٢ۢܢ� ����CO�Ĵ��� PdCl2��H2O��CO===Pd����CO2��2HCl 250 mL����ƿ 2
����������1�����ᾧ����101��ʱ��ʼ�ۻ���150��ʱ��ʼ��������˼��ȷֽ�ʱ���ӷ����IJ��������ʯ��ˮ��ӦҲ������ɫ��������ȷ�𰸣��ӷ����IJ��������ʯ��ˮ��ӦҲ������ͬ��������Ϊ����ơ�������ƶ�Ϊ��ɫ��������
��2���������ȷֽ������ܲ���CO��CO2�����������֤CO����֮ǰ���ȳ�ȥCO2��XӦѡ��NaOH��Һ�� �����CO�ܹ���ԭ����ͭ�������������Ũ�������CO��������ȷ����NaOH������CO��������ȥCO�е�ˮ��������
��3���ȵ�ȼA���ľƾ��ƣ��������壬�ž�װ���ڿ�����Ȼ�����Eװ�÷�Ӧ��������Ӧ��������Ϩ��E���ƾ��ƣ���ȴ�����º���Ϩ��A���ľƾ��ƣ��Է�����������������4���������ȵ����˳��Ϊ�٢ۢܢ�����ȼE���ƾ���ǰ����Ҫ���еIJ����Ǽ���CO�Ĵ��ȣ���ȷ�𰸣��٢ۢܢ�������CO�Ĵ��ȣ������֡��鴿������
��4��PdCl2������CO��Ӧ���ɽ���Pd��CO������ΪCO2����ѧ����ʽΪPdCl2��H2O��CO=== Pd����CO2��2HCl����ȷ����PdCl2��H2O��CO=== Pd����CO2��2HCl��
��5������KMnO4��Һ�����Ϊ9.99+10.01+10.00=10.00mL������KMnO4����Ϊ0.10��10��10-3=10-3 mol��25 mL������Һ����KMnO410-3 mol��250 mL������Һ����KMnO410-2 mol����Ӧ���£�2MnO4��+5H2C2O4+6H+=2Mn2++10CO2��+8H2O�����ݷ�Ӧ��ϵ2MnO4��--5H2C2O4������H2C2O4����Ϊ2.5��10-2 mol��3.15g����H2C2O4��xH2O����Ϊ2.5��10-2 mol��3.15/(90+18x)= 2.5��10-2, x=2����ȷ����2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20��ʱ����H2C2O4��NaOH�����Һ����c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L����̼Ԫ�����ķֲ�����������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
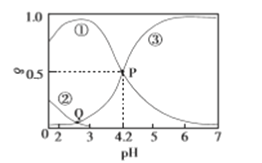
A. ����ʾH2C2O4�ķֲ�����������ʾC2O42-�ķֲ�����
B. Q���Ӧ����Һ��lgc(H+)<lgc(OH-)
C. 20��ʱ��H2C2O4��һ������ƽ�ⳣ��Ka1=1��10-4.2
D. 0.100mol/L��NaHC2O4��Һ�У�c(OH-)=c(H+)- c(C2O42-)+c(H2C2O4)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �����´�����Ӳ����ܴ�����pH>7�ļ�����Һ��
B. ������pH=2��H2SO4��pH=13��NaOH��Һ��ͣ����û��Һ��pH=11����H2SO4��Һ��NaOH��Һ���������9:1
C. 0.1mol/L������Һ�У�c(S2��)+c(HS��)+2c(H2S)=0.1mol/L
D. ���������Ȼ����Һ�м���������ˮʹ��Һ��pH=7��������Һ��c(NH4+)>c(Cl��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ���Ũ����ȵ�NaCl��FeCl2��FeCl3������Һ�ֱ�������ʵ���Ũ�ȵ�AgNO3��Һǡ����ȫ��Ӧ����NaCl��FeCl2 ��FeCl3������Һ�����֮����
A. 1��2��3 B. 3��2��1 C. 6:��3��2 D. 1��1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״����һ�������HCl���壬��������500mL��ϡ������Һ�У�������Һ��������仯��������Һ�м���0.60mol/L��NaOH��Һ50mLǡ�ó����ԡ�����������Ե���Һ�м���������Ȼ�����Һ�����ij���������Ϊ2.33g��
(1)���ɳ��������ӷ�Ӧ����ʽ��_______________________________��
(2)ԭ������Һ��Ũ��Ϊ��______________________________________��
(3)��״����HCl��������Ϊ���ٺ�������д��������̣�__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MnO2 ��Ũ���ᷴӦ��Cl2������0.4molHCl������ʱ�����ɵ�Cl2ȫ����ʯ��ˮ���գ������:
(1)��Cl2�ķ�Ӧ��ת�Ƶ��ӵ���Ŀ?
(2)����Cl2���������״���£�?
(3)�Ƶ�Ư��[CaCl2��Ca( ClO)2�Ļ����]������? (д���������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ�е�ʵ�鷽�����ܴﵽʵ��Ŀ�ĵ���
ѡ�� | ʵ�鷽�� | ʵ��Ŀ�� |
A |
| ��֤FeCl3��H2O2�ֽⷴӦ�д����� |
B |
��NO2������ڱ�ˮ����ˮ�� | ̽���¶ȶ�ƽ��2NO2 |
C |
| ��ȥCO2�����л��е�SO2 |
D |
| �Ƚ�HCl��H2CO3��H2SiO3������ǿ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֤�����淴ӦN2(g)+3H2(g)![]() 2NH3(g)�Ѵﵽƽ��״̬����
2NH3(g)�Ѵﵽƽ��״̬����
��1��N![]() N�����ѵ�ͬʱ����3��H-H������ ��1��N
N�����ѵ�ͬʱ����3��H-H������ ��1��N![]() N�����ѵ�ͬʱ����6��N-H������ ��������������ʱ���������ƽ����Է����������ٸı� �ܺ��º���ʱ����ϵѹǿ���ٸı� ��NH3��N2��H2��������������ٸı� �����º���ʱ�����������ܶȱ��ֲ��� ������Ӧ����v(H2)=0.6mol/(L��min)���淴Ӧ����v(NH3)=0.4mol/(L��min)
N�����ѵ�ͬʱ����6��N-H������ ��������������ʱ���������ƽ����Է����������ٸı� �ܺ��º���ʱ����ϵѹǿ���ٸı� ��NH3��N2��H2��������������ٸı� �����º���ʱ�����������ܶȱ��ֲ��� ������Ӧ����v(H2)=0.6mol/(L��min)���淴Ӧ����v(NH3)=0.4mol/(L��min)
A. ȫ�� B. �ڢۢܢ� C. �ڢۢܢݢ� D. �ۢݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ���ҽ��ж��������Ʊ�������ʵ������װ�ã����̶ֹ�װ��δ�����������й�˵����ȷ����(����)

A. �ر� K1���� K2���Լ� X ������ KMnO4 �� FeCl3 ��Һ������֤�� SO2 �л�ԭ��
B. �ر� K2���� K1���μ����ᣬ��װ�� B ��ÿ���� 1molNa2O2��ת�Ƶ�����ΪNA
C. Ϊ��ֹ������Ⱦ��װ��C��E�е��Լ���ȡ�ñ��͵�ʯ��ˮ
D. ʵ���������������������ԡ���ˮ�ԡ��ѻӷ��ԡ�ǿ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com