
【题目】可以证明可逆反应N2(g)+3H2(g)![]() 2NH3(g)已达到平衡状态的是
2NH3(g)已达到平衡状态的是
①1个N![]() N键断裂的同时,有3个H-H键断裂 ②1个N
N键断裂的同时,有3个H-H键断裂 ②1个N![]() N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
【答案】C
【解析】①无论是否达到平衡状态,只要一个N≡N断裂的同时,就有3个H-H键断裂,所以不能证明该反应达到平衡状态,故错误;②反应达到平衡状态时,只要一个N≡N键断裂的同时,就有有6个N-H键断裂,所以能证明该反应达到平衡状态,故正确;③该反应达到平衡状态时,气体总物质的量不变,气体混合物的质量不变,所以其他条件不变时,混合气体平均相对分子质量不再改变,能说明该反应达到平衡状态,故正确;④该反应是一个气体体积改变的反应,当反应达到平衡状态时,各物质的浓度不变,则其压强也不变,所以保持其他条件不变时,体系压强不再改变,能说明该反应达到平衡状态,故正确;⑤反应达到平衡状态时,各物质的百分含量不变,所以NH3%、N2%、H2%都不再改变能证明说明该反应达到平衡状态,故正确;⑥恒温恒容时,密度始终保持不变,所以不能证明该反应达到平衡状态,故错误;⑦v正(H2)表示消耗H2的速率,v逆(NH3)表示消耗NH3的速率,且v正(H2):v逆(NH3)=3:2,充分说明向两个相反方向进行的程度相当,说明到达平衡状态,故正确;答案选C。


科目:高中化学 来源: 题型:
【题目】体重50 kg的健康人含Fe元素约2 g。主要以Fe2+、Fe3+形式存在于人体内。Fe2+易被吸收,给贫血者补充铁,应补充含Fe2+的亚铁盐(如FeSO4)。服用Vc,可使食物中的Fe3+转化为Fe2+。
①人体中经常进行Fe2+![]() Fe3+的转化,在过程A中,Fe2+做_______剂,过程B中Fe3+做______剂。
Fe3+的转化,在过程A中,Fe2+做_______剂,过程B中Fe3+做______剂。
②Vc使Fe3+转化为Fe2+,VC在这一过程中做___________,具有____________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100mol/L 的AgNO3溶液滴定50.0mL,0.0500mol/L KCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-lgc(Cl-) 、pAg=-lgc(Ag+)随加入AgNO3的体积变化如图所示,已知溶液中离子浓度小于等于1.0×10-5mol/L则沉淀完全,Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,下列说法错误的是( )
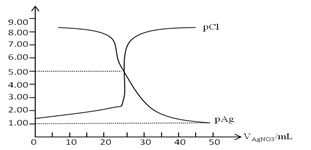
A. AgCl的沉淀溶解平衡常数Ksp数量级为10-10
B. 为防止指示剂失效,溶液应维持中性或弱碱性
C. 滴定中指示剂的有效浓度应维持在2.0×10-2 mol/L
D. 滴定完后加入1mL 0.01mol/L H2SO4会产生新的沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。

(1)a点(横坐标为10)所示溶液中离子浓度从大到小的顺序为___________________ ,其中c(Na+)______c(A-)+c(HA)(填“>”“<”或“=”)。
(2)c点所示溶液中,c(Na+)_____c(A-)(填“>”“<”或“=”)。
(3)b点所示溶液中,c(A-)_____c(HA)(填“>”“<”或“=”)。
(4)a、b、c点所示溶液中,水的电离程度最大的是__________________________。
(5)以下滴定操作会导致V(HA)偏大的是____________。
A、滴定管滴定前有气泡,滴定后气泡消失
B、锥形瓶洗涤后没有干燥
C、滴定时锥形瓶中有液体溅出
D、滴定开始前读数时平视,滴定终点,读数时俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3mol/L NaOH溶液滴入到25mL一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。据图回答:
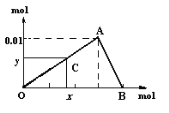
(1)OA曲线表示的离子反应是:__________________________;由此可得A点时加入氢氧化钠溶液的体积为____________;
(2)AB曲线表示的离子反应为:___________,由此可得B点的坐标为:_______。
(3)由上述分析,可求得AlCl3溶液中Al3+离子的浓度为:____mol/L。
(4)当x=0.035时,铝元素在体系中的存在形式为________,其物质的量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH的物质的量
A. 相同 B. 中和HCl的多
C. 中和CH3COOH的多 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着能源危机影响的加剧,全球寻找新能源的步伐加快。下列能源中不属于新能源的是( )
A. 生物质能 B. 天然气 C. 核聚变能 D. 潮汐能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25C时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n随时间1的变化如图1所示,已知反应达到平衡后,降低温度,A的转化率将增大。

(1)根据图1数据。写出该反应的化学方程式:_____________;此反应的平衡常数表达式为K=_________,从反应开始到第一次平衡时的平均速率v(A)为________。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是_________。
(3)图2表示此反应的反应速率v和时间t的关系,t3、t5、t6时刻各改变一个且互不相同的条件,各阶段的平衡常数如下表所示。K1、K2、K3、K4之间的关系为________(用“>”“<”或“=”连接)。A的转化率最大的一段时间是___________。
t2~t3 | t4~t5 | t5~t6 | t7~t8 |
K1 | K2 | K3 | K4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应的限度的叙述,错误的是
A.化学反应的限度与时间的长短无关
B.化学反应达到限度时,正、逆反应速率相等
C.化学反应的限度是不可改变的
D.任何可逆反应都有一定的限度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com